
高尿酸血症と臓器障害
益崎 裕章 先生
琉球大学大学院医学研究科 内分泌代謝・血液・膠原病 内科学講座(第二内科) 教授
ヒトが進化の過程で獲得した再吸収機構
飢餓は古くから生命を脅かしてきた。飢餓に適応し、生命を維持するための仕組みの1つとして、栄養素や機能成分の再吸収機構が発達してきた。食糧が足りない厳しい環境で生き抜いてきたわれわれの祖先にとっては、グルコースやコレステロール、尿酸といった生体維持に不可欠な機能成分を再吸収し、体内に貯留することが生命維持に必須であった。
しかしながら、食糧が容易に手に入る状況となった今では、皮肉なことにメタボリックシンドロームや肥満症、高インスリン血症などの病態が尿酸の再吸収を亢進させ、高尿酸血症の病態形成をつくり出している(図1)。
安土桃山時代、『日本史(Historia de Japam)』のなかでルイス・フロイスが記した「日本人には痛風の患者さんが1人もいない」という記載は、高尿酸血症がまさに現代病としての側面を有することを示している。
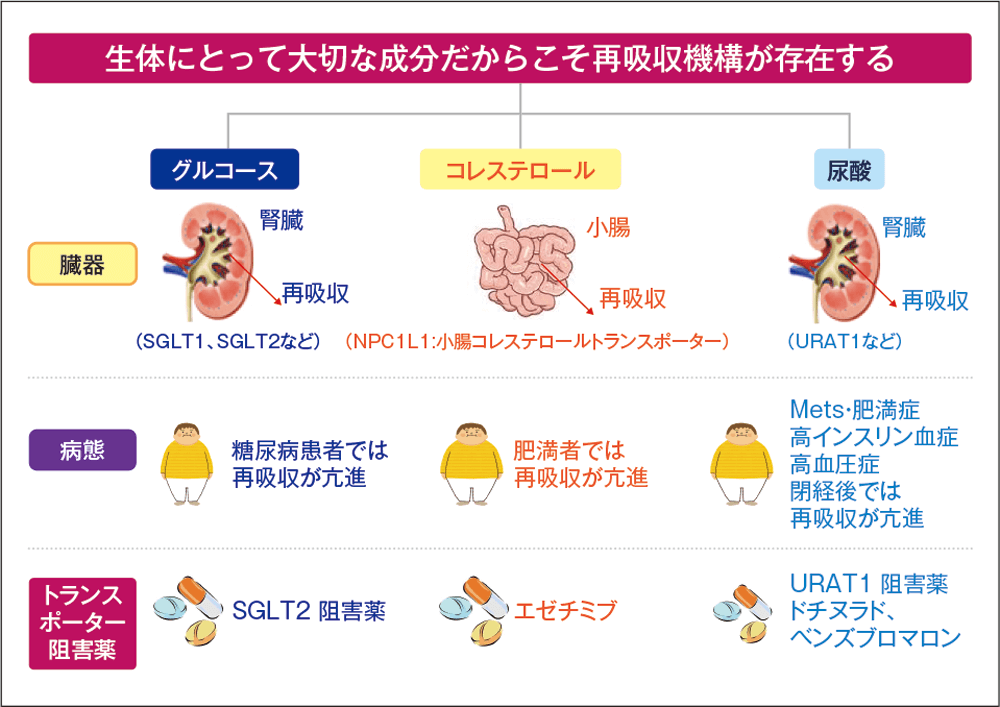
図1
生体内再吸収機構と高尿酸血症
SGLT:sodium-glucose cotransporter
NPC1L1:Niemann-Pick C1-like 1
Mets:Metabolic Syndrome
益崎先生 作成
高尿酸血症の病態と臓器障害の関係
高尿酸血症は痛風関節炎の独立した危険因子であるだけでなく、血管内皮障害や動脈硬化症を引き起こし、主要臓器の機能に大きな悪影響を及ぼす。ここでは尿酸によるインフラマソームの活性化、尿酸の細胞内流入、キサンチン酸化還元酵素(XOR)由来の酸化ストレスにより炎症や組織障害が引き起こされるメカニズムについて解説する。
1.尿酸によるインフラマソームの活性化と臓器障害
自然免疫とは、病原体関連分子パターン(PAMPs)と総称される一連の病原体成分を細胞が感知し、炎症応答によりこれらを除去しようとする第一線の生体防御システムである。一方で、自然免疫は栄養過多により蓄積する生体内物質にも反応し、過度の炎症による組織傷害を引き起こす負の側面があることが明らかになっている。
栄養過多により尿酸塩結晶などの生体内物質が蓄積されると、単球/マクロファージはこれをダメージ関連分子パターン(DMAPs)と呼ばれるDanger signalとして感知し、キサンチン酸化酵素(XO)が活性化されて活性酸素を生み出す。さらに、尿酸塩結晶などの生体内代謝物質は自然免疫関連受容体であるNLRP3を包含するNLRP3インフラマソームを活性化して、カスパーゼ-1からインターロイキン(IL)-1βなどの炎症性サイトカインを過剰に放出することで炎症を誘導する。
NLRP3インフラマソームが活性化して炎症が誘導されたあとも、原因となった尿酸塩結晶は病原体のように除去されない。そのため炎症が持続し、臓器障害の進展・悪化に繋がっていくと考えられる。
2.血管構成細胞内への尿酸取り込みによる組織障害
血管構成細胞に対する尿酸の直接的悪影響の1つとして、尿酸トランスポーターであるURAT1を介した細胞内流入が知られている。尿酸はその生理的役割として抗酸化作用を有し、血管内では本来、善玉として働く物質である。日本人の高尿酸血症のおよそ8割は尿酸排泄低下型と推定されているが、これまでに痛風発作などを起こしたことがない、いわゆる“無症候性高尿酸血症“において、尿酸排泄促進薬により血液中から善玉物質である尿酸を減らすことの妥当性、尿酸の血管内と細胞内における生理的・病態生理的意義が異なる可能性については長年にわたり、国際的議論が重ねられてきた。
このような背景のなか、近年、URAT1が腎臓だけではなく血管内皮細胞、血管平滑筋細胞や脂肪細胞など、全身に広範囲に発現することが明らかとなった。細胞外で高尿酸血症の状態が持続すると、URAT1を介して尿酸が細胞内に取り込まれ、それらが酸化ストレスを増加させて、血管平滑筋細胞や血管内皮細胞に炎症を引き起こす可能性が注目されている(図2)。
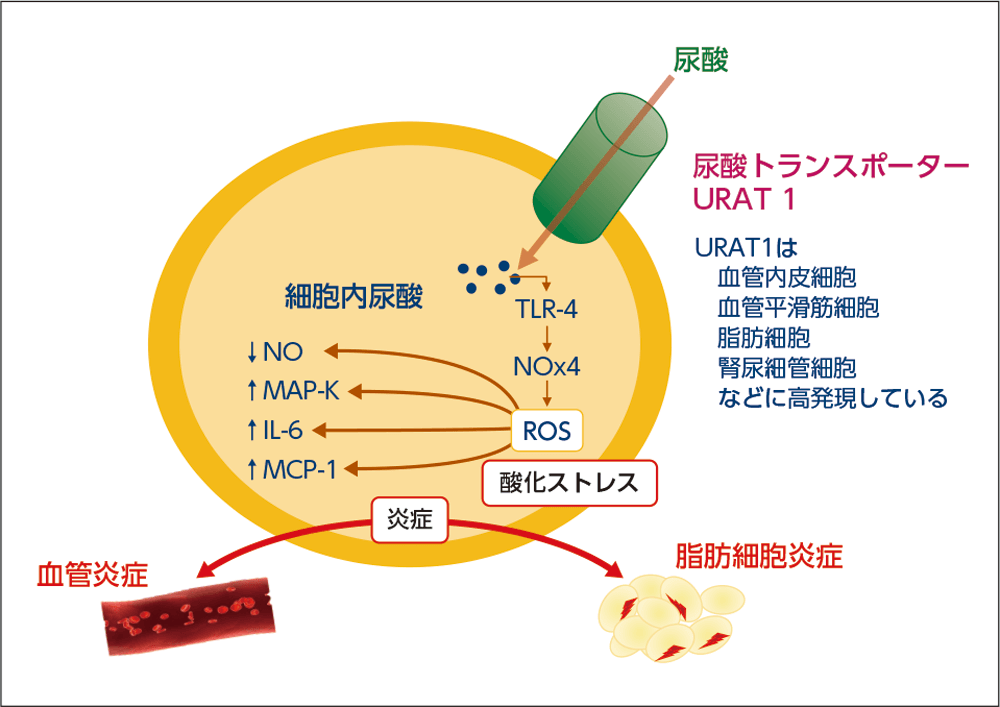
図2
尿酸の細胞内流入による炎症惹起
NO:一酸化窒素、MAP-K:マイトジェン活性化プロテインキナーゼ、
MCP-1:単球走化性促進因子、TLR-4:Toll様受容体4、
NOx4:NADPHオキシダーゼ4
益崎先生 作成
3.XO由来の酸化ストレスによる臓器障害
XORは尿酸生合成経路における律速酵素として機能するが、XORは還元型のキサンチン脱水素酵素(XDH)と酸化型のXOという両方向性の活性を有している。XORは主に肝臓と消化管(小腸)においてXDHとして発現しているが、炎症や虚血などの細胞障害時に血中に放出されたXDHは、血管内皮細胞に発現しているプロテアーゼによってXOに変換され、さらにプロテオグリカンによって血管内皮細胞に係留される。
血管内皮細胞に係留されたXOは活性酸素種(ROS)の産生源となり、全身臓器において酸化ストレスを亢進させ、臓器障害に関与すると考えられる。尿酸を産生するXOが過剰に働く病態においては酸化ストレスで血管が傷害され、種々の臓器障害を引き起こす基盤となる(図3)1)2)。
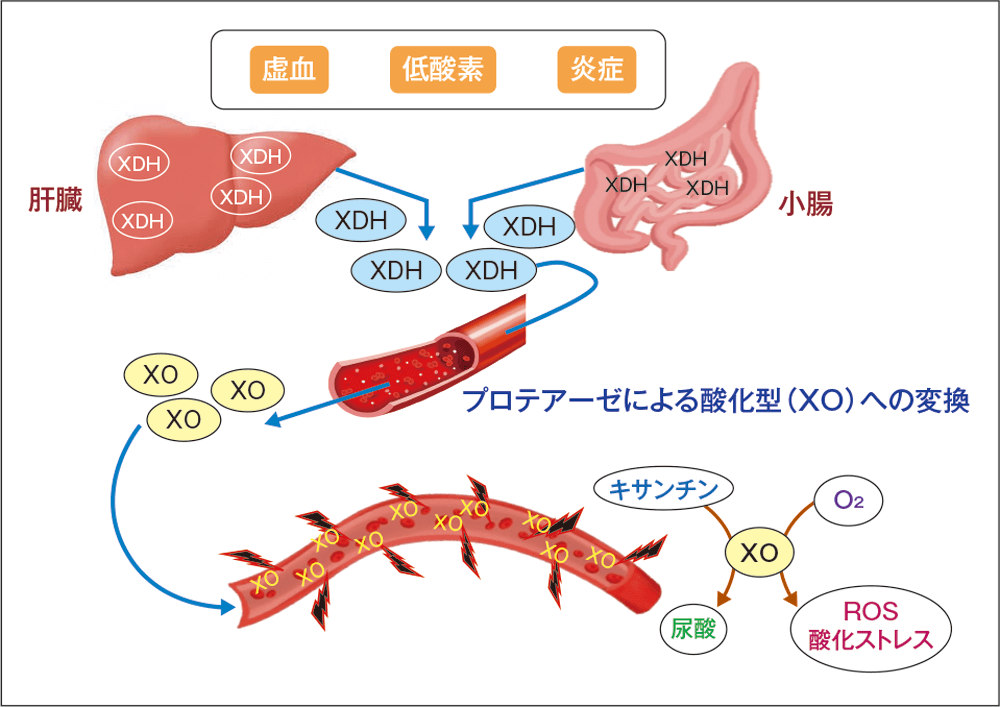
図3
XO由来の酸化ストレスによる臓器障害
O2:酸素
文献1)2)より引用作図
臓器障害への進展を食い止めるアプローチ
1.高尿酸血症への介入の意義
高尿酸血症の治療について、『高尿酸血症・痛風の治療ガイドライン第3版(2019年改訂)』3)では、高尿酸血症の発症に関連する生活習慣を改善することを重視しながら、痛風関節炎や痛風結節を認める患者への治療目標は血清尿酸値6.0mg/dL以下の維持を明確に示している。しかし、無症候性高尿酸血症への介入については血清尿酸値8.0mg/dL以上で「考慮する」という曖昧な表現にとどまっており、どこまで尿酸値を低下させるべきかの議論も依然として混沌としている。
しかし、痛風発作を起こしていなくても過剰な細胞内尿酸による炎症の惹起やXO由来の酸化ストレスによる血管内皮機能障害、臓器障害により、心血管・脳血管障害などのイベントリスクが上昇するため、痛風発作、関節炎予防のための尿酸管理という古典的概念を超え、高尿酸血症の治療においては血清尿酸値8.0mg/dL以上を介入の目安とし、なるべく早期に薬物治療の導入を検討することが長期的予後や生活の質(QOL)向上に貢献すると考えられる。
2.薬剤選択の考え方のポイント
高尿酸血症により惹起される臓器障害を阻止するために可能なアプローチとしては、尿酸の過剰な細胞流入とXO由来のROSによる血管内皮機能障害および臓器障害という2つの面を考慮する必要がある。前者に対しては、尿酸排泄低下型高尿酸血症に選択性の高い薬剤として登場したURAT1阻害薬、後者では過剰なXOを阻害する目的でこれまで広く臨床使用されてきたXOR阻害薬の選択が適していると考えられる。
ドチヌラドは従来の尿酸排泄促進薬に比べ、強力かつ選択的にURAT1を阻害し、かつ尿酸排泄に関与するABCG2、OAT1、OAT3に対する抑制効果がきわめて少ないのが特徴である4)5)。
選択的かつ強力にURAT1を阻害する働きにより、ドチヌラドは腎臓からの排泄低下を改善して尿中に尿酸を放出するのみならず、全身に広範囲に発現するURAT1を介した尿酸の細胞内流入による悪影響を阻止する効果が期待できる。
一方のXOR阻害薬も、血管組織や脂肪組織、腎臓、肝臓などのXORの過剰な活性化を緩和することで、全身の酸化ストレスを軽減する代謝ストレス消去剤(metabolic stress eraser)としての意義が期待される。
高尿酸血症の薬物治療における今後の展望
URAT1阻害薬およびXOR阻害薬は互いに他方を補完する特徴を備えているため、血清尿酸値の低下にやや難渋する例では、両系統の薬剤を併用することも有用な治療戦略になる。今後、臨床においてURAT1阻害薬やXOR阻害薬の使用経験が蓄積され、基礎面だけでなく臨床面において新たなエビデンスが証明されれば、効果的な尿酸降下療法を選択するための手がかりが増え、ガイドラインにおいても、より明確な治療指針が示されるものと期待される。
References
1) Kelley EE,et al.Arch Toxicol.2015;89:1193-207.
2) Sunagawa S,et al.J Diabetes Investig.2019;10:94-103.
3) 日本痛風・核酸代謝学会ガイドライン改訂委員会(編).高尿酸血症・痛風の治療ガイドライン第3版(2019年改訂).東京:診断と治療社;2018.
4) 社内資料:ヒトABCG2、OAT1及びOAT3発現細胞を用いた尿酸取り込み阻害試験(CTD 2.6.2.2)
5) Taniguchi T,et al.J Pharmacol Exp Ther.2019;371:162-70.



