
⾼尿酸⾎症とCKDのエビデンス~最近の知見
仲川 孝彦 先生
滋賀医科大学再生医療開拓講座 特任教授
尿酸は単なるマーカーか?
尿酸はかつて単なる代謝産物であり、生物学的活性をもたないとみなされていた。よって、高尿酸血症は腎機能障害や高血圧などを合併することが多いものの、尿酸はそれら疾患の単なるマーカーであり、疾病要因ではないというのが一般的な考え方であった。もし尿酸がマーカーであるならば、高尿酸血症は治療対象とはならず、積極的に介入する必要はないといえる。
しかしながら、沖縄一般住民を対象に血清尿酸値と末期腎不全の関係について調べたコホート研究では、男性の末期腎不全累積発症率は、血清尿酸値 7.0mg/dL未満に比べ7.0mg/dL以上では約4倍であり、女性では6.0mg/dL未満に比べ6.0mg/dL以上では約10倍であった1)。同コホートでは、1993年と2003年に血清尿酸値と血清クレアチニンを測定した受診者を特定し、血清尿酸値上昇が推算糸球体濾過量(eGFR)低下と関連していたことも示されている2)。
また、米国の6〜18歳の未治療原発性高血圧患者を対象とした研究では、血清尿酸値と収縮期血圧で強い相関関係が認められた3)。加えて我々の研究では、初回心筋梗塞の非糖尿病患者を対象としたところ、血清尿酸値 5.5mg/dL以上の群は、6ヵ月後および12ヵ月後の高インスリン血症を独立して予測し得ることが明らかとなった4)。
これらの観察研究の結果から、尿酸そのものが腎機能の悪化に直接および間接的に関与している可能性が示唆された。そこで我々のグループは尿酸の役割について検討すべく、動物モデルを用いた研究を開始した。
高尿酸血症モデルラットによる検討
尿酸の役割を検討するため、まずは高尿酸血症を呈するラットモデルを作製した。ヒトと異なりラットはウリカーゼという酵素を有するため、尿酸はアラントインに変換される。そこで我々は、このウリカーゼを抑制するoxonic acidを投与してラットに高尿酸血症を誘導することを考えた。
ちなみに、血清尿酸値が高度に上昇すると尿酸塩結晶が腎臓内に沈着し、それ自体が炎症作用を有するため、尿酸による影響と尿酸塩結晶による作用が混在し、尿酸そのものの役割を検討することが困難である。我々はoxonic acidを2%に調整することで腎臓内尿酸塩結晶を生じさせず、高尿酸血症の役割を検討するのに適した動物モデルを作製することができた5)。
このラットの血圧を測定すると、正常ラットの収縮期血圧は120mmHg程度であるが、2週後には140mmHgまで上昇した。しかし、このモデルにあらかじめアロプリノールやbenziodarone(尿酸排泄促進薬)を投与すると、血圧上昇は有意に抑制された5)。また、高尿酸血症モデルラットは6ヵ月後に有意にアルブミン尿を呈し、高尿酸血症による7週後の糸球体肥大、6ヵ月後の糸球体硬化症の発症が示唆される結果となった6)。ほかにも、高尿酸血症モデルラットは尿細管間質線維化をきたし7)、傍糸球体装置でレニン発現が促進されるが5)、いずれもアロプリノール投与により抑制されることが明らかとなった。
さらに我々は5/6腎摘モデルラットに高尿酸血症を発症させ、動脈硬化をもたらす血管平滑筋細胞の増殖を認めたほか8)、尿酸による用量依存的なアセチルコリンの低下が血管内皮細胞機能を抑制することを認めた(図)9)。
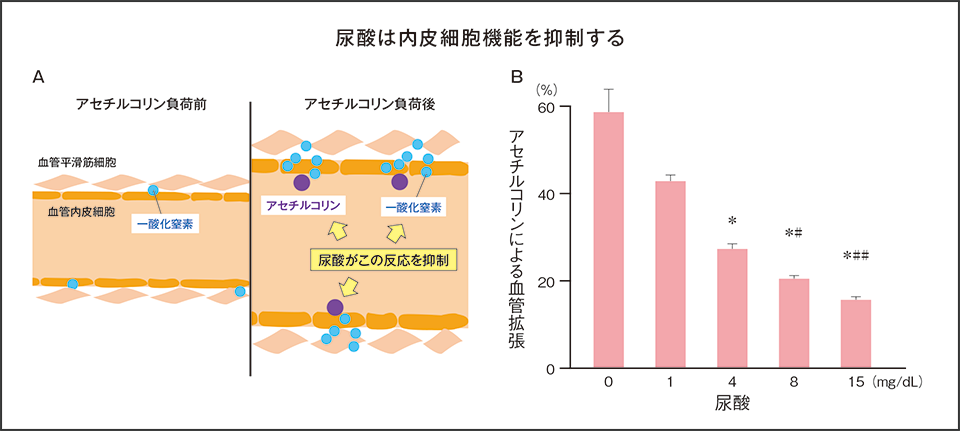
図
尿酸による血管内皮細胞機能阻害
アセチルコリン(紫)により刺激された内皮細胞は多量の一酸化窒素(NO:水色)を放出する。そのNOが平滑筋細胞を弛緩させるため、血管内腔が拡張する。尿酸はNOの産生を抑制するため、アセチルコリンによる血管拡張は抑制される。
*:p<0.01 vs. コントロール、#:p<0.05 vs. 0.7mg/dL 尿酸、##:p<0.01 vs. 0.7mg/dL 尿酸
A:仲川先生 作成、B:文献9)より引用
臨床試験による高尿酸血症とCKDの検討
このような動物モデルを用いた報告が増えるにつれ、さまざまな研究グループが小~中規模の臨床試験に着手しはじめた。ここではその一部を紹介する。
高尿酸血症を伴う慢性腎臓病(CKD)患者54名を対象とした研究では、アロプリノール群がプラセボ群に比べ有意に血清クレアチニンの変化率を抑制した10)。また、CKD(stage G3)患者113名を対象とした研究では、2年間の観察中、アロプリノール群はeGFRが低下せずむしろ上昇していたが、コントロール群は有意に低下していた11)。これらの少数例の検討から、動物モデルを用いた研究と同様、尿酸を下げることで腎機能低下を抑制する可能性が示唆された。
その後、尿酸降下薬による腎機能低下の抑制効果を検討すべく、いくつかのランダム化比較試験(RCT)が実施されている。
まずFEATHER Studyでは、高尿酸血症を合併したCKD G3a、3bの443名をフェブキソスタット群とプラセボ群に割り付け、約2年間観察した結果、フェブキソスタット群では血清尿酸値が有意に低下して痛風関節炎の発現が抑制されたが、主要評価項目であるeGFRの変化について両群間に有意差は認められなかった12)。
また、CKD-FIX studyは、CKD G3-G4かつ尿アルブミン 265mg/gCre以上で痛風発作歴のない363名をアロプリノール投与群とプラセボ群に割り付け、約2年間観察したが、eGFRの変化について両群間に有意な差は認められなかった13)。
さらに、PERL studyはeGFR 40.0〜99.9mL/min/1.73m2、アルブミン尿陽性、尿酸値4.5mg/dL以上の1型糖尿病患者約530名をアロプリノール群とプラセボ群に割り付け、約3年間観察したが、こちらもGFRの変化について両群間に有意差は認められなかった14)。
高尿酸血症とCKDにおけるエビデンスの課題
少数例での検討と異なり、RCTの多くで有意差がつかなかった理由として、組み入れ患者の選択基準や観察期間など、試験デザインによる影響が考えられる。たとえば、CKD-FIX studyにおいては、登録症例から痛風発作歴のある患者が除外されたことや試験を中止した患者の割合が高かったこと、観察期間が短かったことなどが挙げられる。
PERL studyの登録患者は平均年齢51歳、糖尿病の平均罹病期間は34.6年であるが、平均eGFRは74mL/min/1.73m2と、長期にわたり腎機能が正常に保たれていた背景を有する。
CKD患者における尿酸降下療法の効果を検討した22件のRCT(対照群を設定した14件のRCTを含む)のレビューでは、コントロール群が観察中に腎機能の低下(≧4mL/min/1.73m2と定義)を認めた試験において尿酸降下療法が一貫して臨床的メリットをもたらしたことを指摘している15)。
また、尿酸降下薬による腎保護効果を検討するにあたり、患者のベースラインの血清尿酸値がさほど高くなければ、尿酸降下による影響を評価するのは難しい。尿酸は血圧を上昇させるが、臨床では高血圧に対する降圧薬投与が行われており、すでに血圧が下げられた状況で尿酸降下薬による有意な差を得るには長期観察期間が必要であろう。
高尿酸血症は単なるマーカーではなく、それ自体が腎臓やその他の臓器障害をもたらすことは、動物実験や少数例の臨床試験から明らかとなっている。今後はより吟味されたデザインの大規模臨床介入試験により、CKDに対する高尿酸血症の治療意義などの確立が望まれる。
References
1) Iseki K,et al.Am J Kidney Dis.2004;44:642-50.
2) Iseki K,et al.Hypertens Res.2013;36:650-4.
3) Feig DI,et al.Hypertension.2003;42:247-52.
4) Nakagawa T,et al.Nat Clin Pract Nephrol.2005;1:80-6.
5) Mazzali M,et al.Hypertension.2001;38:1101-6.
6) Nakagawa T,et al.Am J Nephrol.2003;23:2-7.
7) Ryu ES,et al.Am J Physiol Renal Physiol.2013;304:F471-80.
8) Kang DH,et al.J Am Soc Nephrol.2002;13:2888-97.
9) Nakagawa T,et al.Am J Physiol Renal Physiol.2006;290:F625-31.
10) Siu YP,et al.Am J Kidney Dis.2006;47:51-9.
11) Goicoechea M,et al.Clin J Am Soc Nephrol.2010;5:1388-93.
12) Kimura K,et al;FEATHER Study Investigators.Am J Kidney Dis.2018;72:798-810.
13) Badve SV,et al;CKD-FIX Study Investigators.N Engl J Med.2020;382:2504-13.
14) Doria A,et al;PERL Study Group.N Engl J Med.2020;382:2493-503.
15) Sato Y,et al.Nat Rev Nephrol.2019;15:767-75.



