
コロナ禍における尿酸管理の重要性
山本 匡 先生
オクノクリニック・東京Dタワーホスピタル
COVID-19と高尿酸血症
WHOによる新型コロナウイルス(SARS-CoV-2)感染症(COVID-19)パンデミックの宣言(2020年3月)から2年半以上が経過した。SARS-CoV-2ウイルスは伝播の過程で変異を繰り返し感染力が上がった一方で、現在主流となっているとされるオミクロン株による感染では、たとえばデルタ株による感染と比較して重症化リスクは低いとされる。ただし、高齢者や基礎疾患を有する人では依然として重症化リスクが高いことや感染により基礎疾患が悪化して死亡する例もあるとされ、引き続き注意していく必要がある。
高齢、男性、肥満などに加えて、これまで高血圧1)、慢性肺疾患2)、2型糖尿病3)がCOVID-19重症化のリスク因子となる基礎疾患として指摘されてきたが、最近、高尿酸血症とCOVID-19重症化および死亡との関連性が注目されている。
たとえば、2020年3月までに積極的疫学調査で収集された516例4)の国立感染症疫学センターによる解析の中間報告では、COVID-19の重症化リスク因子として高尿酸血症のICU入室のリスクは男性に次いで高く、ハザード比は4.0[95%信頼区間(CI)1.2〜13.5]であり、人工呼吸器装着あるいは死亡については最もリスクが高く、ハザード比は3.2(95%CI 1.0〜10.7)であった5)。また2020年9月、高尿酸血症とCOVID-19による死亡の関連性が慶應義塾大学関連病院の研究グループで治療を受けた345例の後方視的解析により示され、論文報告されている6)。多変量解析におけるハザード比は慢性腎臓病(CKD)、高齢に続いて高尿酸血症が高く、COVID-19による死亡の独立した強いリスク因子だった。ハザード比はCKD 5.74(95%CI 1.56〜21.07、p=0.009)、高齢 5.43(95%CI 2.68〜11.01、p< 0.001)、高尿酸血症 3.60(95%CI 1.07〜12.09、p=0.038)であった。そして最近、2020年2月〜2021年5月までのJapan COVID-19 Task Forceの登録症例から日本人以外、血清尿酸値不明、侵襲的人工呼吸管理(IMV)使用の有無が不明な症例を除いた1,523例の解析により、血清尿酸値とIMV使用の間にはU字曲線の関係があること、IMV使用を予測する血清尿酸のカットオフ値が7.6mg/dLであることが示された7)。著者らはこれ以前に、大規模なゲノム関連研究により高尿酸血症関連の遺伝子とCOVID-19の重症度との関連性についても示しており8)、論文中で考察されている通り、入院時の血清尿酸高値および高尿酸血症の既往はCOVID-19重症化を予測する独立した因子である可能性があると考える。
こうしたことから、コロナ禍の時代において高尿酸血症は痛風発作あるいは心血管疾患や生活習慣病による死亡リスクとしてのみならず、COVID-19重症化を防ぐという意味においても対処すべき重要な疾患だと考えていいのではないか。
COVID-19による血管内皮細胞障害
重症COVID-19患者では低酸素状態および極度の炎症状態にあるのみならず、肺塞栓症、深部静脈塞栓症や虚血性脳卒中といった血栓症が認められる9)-12)。肺がSARS-CoV-2ウイルスに攻撃されると、肺胞の炎症性細胞の浸潤とともに上皮細胞および内皮細胞が障害され、早期反応としてインターロイキン(IL)-1β、IL-6、腫瘍壊死因子(TNFα)といった炎症性サイトカインが高レベルで誘導される。重症患者ではこの免疫反応が過剰となっており(サイトカインストーム)、全身性の炎症反応が促進される12)-14)。内皮障害や凝固亢進の状態から考えると、重症患者における血栓症は、酸欠状態と免疫誘発性の炎症が組み合わさることによって引き起こされると考えられる10)12)15)。また、COVID-19関連の酸欠状態は血管収縮および血流低下を招き、内皮障害に寄与することも報告されており10)15)16)、重症COVID-19患者は低血流と内皮障害、凝固促進により血栓症のリスクが非常に高い状態にあるといえる17)18)。
SARS-CoV-2ウイルスによるこうした反応は、「血管が錆びついている(内皮障害がある)」状況においてはより顕著に起こる現象であるといえる。つまり、もともと血管が錆びついている人がCOVID-19に罹患すればより血栓症に陥りやすく、また重症化しやすいと考えられる。オミクロン株では、従来株と比較して病原性は低下しているかもしれないが、重症化のリスク因子といわれるような基礎疾患(高血圧、慢性肺疾患、2型糖尿病、そして高尿酸血症)をもち、血管内皮障害を起こしているような人はやはり重症化しやすいことが懸念される。
メタボリックシンドロームとXOR活性
血清尿酸高値となる原因の1つは、尿酸の過剰産生である。尿酸はキサンチン酸化還元酵素(XOR)の働きにより合成されるが、その過程において同時に活性酸素(ROS)が発生し、酸化ストレスが亢進する。高尿酸血症では過剰な酸化ストレスにより血管内皮機能が低下した血管が錆びついた状態にあることが想定される。また、高尿酸血症の人では動脈硬化のリスク因子であるメタボリックシンドローム(高血圧、脂質異常症、糖代謝異常)が併存することが多い。高尿酸血症そのものが動脈硬化性疾患のリスク因子であるかどうかについては異論もあるが、基礎研究などでその可能性が示され、尿酸と尿酸合成時に発生されるROSによるいくつかの細胞内シグナル経路の制御や変化が、高尿酸血症における動脈硬化進展に関与するとされる19)。また臨床においても、国内の観察研究「EPOCH-JAPAN研究」で尿酸値が高い症例では心血管疾患リスクが有意に高かったことが示されている20)ほか、前向き試験のメタ解析で高尿酸血症が心血管疾患および全死亡と有意に相関することが報告されている21)。
また、XORは肥満マウスの内臓脂肪組織で発現が上昇し、減量によりこれが低下すること22)やXOR遺伝子発現により脂肪細胞における脂肪蓄積が増強され、酸化ストレスが上昇して、加齢による肥満やインスリン抵抗性が上昇すること23)が報告されるなど、メタボリックシンドロームにおける血清尿酸値上昇や酸化ストレス亢進の背景にはXORの活性化があることが示唆されている。また臨床でも、心不全患者においてXOR阻害薬であるアロプリノール投与により内皮機能が改善し、これが酸化ストレスの改善によるものであること、尿酸排泄促進薬のプロベネシドでは改善は認められなかったことが報告されている24)。
高尿酸血症は尿酸排泄低下型、腎負荷型(尿酸産生過剰型と腎外排泄低下型)そして両者の特徴をもつ混合型に分類される。メタボリックシンドロームを有する高尿酸血症患者は、尿酸産生過剰型でXORが活性化して内皮機能が低下していることが想定されるため、炎症疾患ともいえるCOVID-19の流行下においては、XOR阻害薬の選択が適切かもしれない。
尿酸管理の重要性について
高尿酸血症は痛風発作や腎障害の原因となるだけでなく、メタボリックシンドロームに関連するさまざまな疾患を発症および増悪させること、さらにこのコロナ禍においてはCOVID-19重症化のリスク因子であることも念頭においたケアが必要となる。COVID-19重症化予防の観点からは、ワクチン接種と基礎疾患に対するマネジメントという2つの手立てがある。COVID-19の重症化や死亡リスクとして年齢は変えられないが、その他のリスク因子に関しては、糖尿病であればヘモグロビンA1cを7.0%未満にする、高血圧であれば130mmHg/80mmHg未満、血清尿酸値は6.0mg/dL、といったように、それぞれマネジメントの目標値が存在する。その数値を保つ努力をすること、生活を整えることが重要となる。
ただ実際には、コロナ禍で通院が容易ではないという問題もある。筆者の担当する糖尿病患者74名では、2020年の調査で、前回通院から体重が増えた患者は体重が減少ないし変化しなかった患者に比べて尿酸値が有意に上昇していた(表)。アルコールや高プリン体食の過剰摂取、かつ運動不足というステイホームの影響が血清尿酸高値として現れたかたちである。
さまざまな基礎疾患や素因のコントロール不良として最初に目にみえるのが、実は尿酸値であると考える。たとえば30歳代、40歳代において血清尿酸値の上昇をシグナルとして追跡すれば、40歳代、50歳代の時点でまず高血圧、次に糖尿病を発症するという経過をたどる可能性が高いと考えられる。ただ、現在の治療ガイドラインではエビデンスが不十分なために薬物治療開始の閾値が基礎疾患の有無にかかわらず設定されていることもあり、痛風発作に至るまで無治療のケースも多々みられる。今、このコロナ禍の時代だからこそ、医師も患者もより高尿酸血症に注目し、先を見据えた健康管理を行うとともに、これを機会にすでに基礎疾患が併存する高尿酸血症患者に対しては、酸化ストレスを軽減するような薬物療法のエビデンスを確立し、予防医学への道筋を立てていくことも重要ではないだろうか。
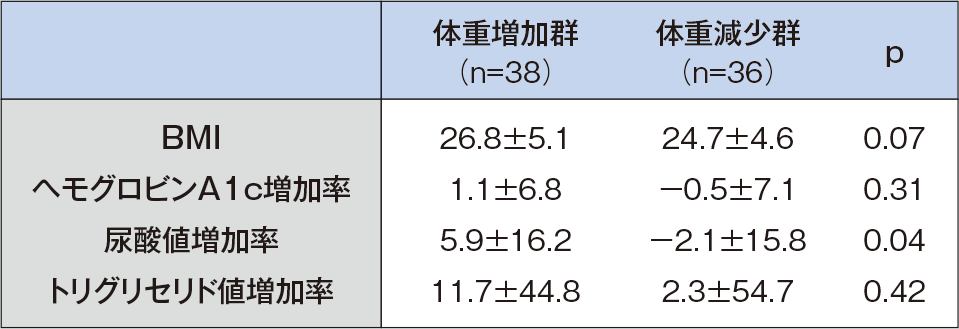
表
体重増加群と体重減少群の比較
山本匡.Prog Med.2020;40:1337-40.より引用
References
1) Pranata R,et al.J Renin Angiotensin Aldosterone Syst.2020;21:1470320320926899.
2) Leung JM,et al.Eur Respir J.2020;56:2002108.
3) Targher G,et al.Diabetes Metab.2020;46:335-7.
4) 国立感染症研究所.感染症発生動向調査及び積極的疫学調査により報告された新型コロナウイルス感染症確定症例516例の記述疫学(2020年3月23日現在). https://www.niid.go.jp/niid/ja/covid-19/9533-covid19-14-200323.html(閲覧:2022-11-1)
5) 厚生労働省.鈴木基.COVID-19の致命率と重症化リスク因子について. https://www.mhlw.go.jp/content/10900000/000662183.pdf(閲覧:2022-11-1)
6) Ishii M,et al;Keio COVID-19 Research Consortium (K-CORC) and the Keio Donner Project Team.J Infect.2020;81:e3-5.
7) Fukushima T,et al;Japan COVID-19 Task Force.Int J Infect Dis.2022;122:747-54.
8) Namkoong H,et al.medRxiv.2021;1-36.doi: https://doi.org/10.1101/2021.05.17.21256513
9) Klok FA,et al.Thromb Res.2020;191:145-7.
10) Helms J,et al;CRICS TRIGGERSEP Group(Clinical Research in Intensive Care and Sepsis Trial Group for Global Evaluation and Research in Sepsis).Intensive Care Med.2020;46:1089-98.
11) Lodigiani C,et al;Humanitas COVID-19 Task Force.Thromb Res.2020;191:9-14.
12) Bikdeli B,et al;Global COVID-19 Thrombosis Collaborative Group,Endorsed by the ISTH,NATF,ESVM,and the IUA,Supported by the ESC Working Group on Pulmonary Circulation and Right Ventricular Function.J Am Coll Cardiol.2020;75:2950-73.
13) Zhang W,et al.Clin Immunol.2020;214:108393.
14) Tu WJ,et al.Intensive Care Med.2020;46:1117-20.
15) Varga Z,et al.Lancet.2020;395:1417-8.
16) Liu PP,et al.Circulation.2020;142:68-78.
17) Tang N,et al.J Thromb Haemost.2020;18:1094-9.
18) Thachil J,et al.J Thromb Haemost.2020;18:1023-6.
19) Kimura Y,et al.Int J Mol Sci .2021;22:12394.
20) Zhang W,et al.J Atheroscler Thromb.2016;23:692-703.
21) Li M,et al.Sci Rep.2016;6:19520.
22) Cheung KJ,et al.Cell Metab.2007;5:115-28.
23) Murakami N,et al.Arterioscler Thromb Vasc Biol.2014;34:44-51.
24) George J,et al.Circulation.2006;114:2508-16.



