

高尿酸血症と心不全
心不全患者においては高尿酸血症の合併はしばしば認められ、血清尿酸値と予後の関連も示唆されている。しかしながら、心不全における尿酸の病態生理学的意義については詳細が不明であり、尿酸降下薬による介入効果についても明確なエビデンスは得られていない。そこで今回は、高尿酸血症合併心不全患者に対する臓器保護の視点も含めた尿酸管理のあり方、薬剤選択の考え方について、各種ガイドラインにおける推奨なども踏まえつつ、本領域のエキスパートに対談いただいた。
心不全患者の病態および筋力低下
山本先生
わが国の心不全有病率は男女とも年齢とともに上昇することが報告されています1)。しかも、多くの心不全患者は合併症を抱えており2)、NYHA心機能分類Ⅲ/Ⅳの患者を対象とした検討から3)、駆出率が低下した心不全(heart failure with reduced ejection fraction:HFrEF)に比べ駆出率が保持された心不全(heart failure with preserved ejection fraction:HFpEF)では合併症がより病態を複雑化させていることがわかります。
特に近年、合併症のなかで注目されているのがフレイルです(表1)。わが国のデータでも、心不全患者におけるフレイル、プレフレイルの頻度は高く4)、フレイルを合併した心不全患者は非合併患者に比べて予後が不良です5)。
フレイルは多くの要素で構成されますが、そのなかで以前からわれわれが着目しているものが「筋力低下」です。筋力低下の概念にはサルコペニアとダイナペニアがあり、前者は主に筋肉量減少、後者は筋肉量が保持されている場合の低筋力などと定義されています(図1)。
心不全患者の運動耐容能を6分間歩行距離で評価すると、筋肉量減少よりも筋力低下が影響することが明らかです6)。筋力というと手足の骨格筋が想起されがちですが、運動耐容能の評価においては、四肢の筋力とは独立して横隔膜を中心とする呼吸筋に着目すべきと考え、先ほど述べたように合併症の影響が強く、フレイルにしばしば合併するHFpEF患者を対象とした呼吸筋トレーニングの効果を検証しました。
トレーニングの方法は、1日に1回20分、患者の最大吸気圧(MIP)の30%相当の抵抗に設定し、24週間継続するというものです。12週の時点で呼吸筋機能は有意に向上しましたが、その後12週継続しても変化は認められませんでした7)。ただ、運動耐容能を嫌気性代謝閾値(AT)で評価すると12週時から24週にかけて向上しており、必ずしも呼吸筋機能が直接的に運動耐容能と相関しないことがわかります。そこで、呼吸筋トレーニングの血流依存性血管拡張反応(FMD)への効果を検討したところ、12週の呼吸筋機能が向上した段階ではなく、24週で有意差が認められました7)。この結果から、トレーニングにより血管内皮機能が遅れて改善し、運動耐容能の改善と関連する可能性が示唆されます。実際、呼吸筋が疲弊すると中枢神経に情報が伝わって交感神経が活性化し、末梢血管が収縮して四肢血流量が減少、筋力・持久力が低下して運動耐容能が低下するというrespiratory muscle metaboreflexの概念も提唱されており8)、高齢者、特にHFpEFでの血流量や筋力・持久力の改善には血管内皮機能の改善が一助となっている可能性が推察されます。
また、栄養障害と筋力低下の関係は以前から指摘されているところです。特にわれわれはカルニチンに注目していますが、体内のカルニチンの75%は食事から摂取し、体内では98%が骨格筋に貯蔵されています9)。カルニチンは、サイトゾルからミトコンドリアに長鎖脂肪酸を輸送し、クエン酸(TCA)回路を回してATP産生に寄与するほか、各種代謝産物をミトコンドリア外へ放出する作用もあり、ミトコンドリアの環境を整えるのに重要な役割を果たすと考えられます。
そこでわれわれは心不全患者124名を対象に筋力低下とカルニチンの関係について検討を行ったところ、カルニチン欠乏者が全体の46.8%であり、非欠乏者に比べて筋力低下の比率が高い結果となりました10)。そこでカルニチン欠乏と筋力低下の患者背景に注目すると、骨格筋指数(SMI)、BMIが強く関係しており、これを裏付けるように、カルニチン欠乏の程度を示す指標としてアシルカルニチンと遊離カルニチンの比を算出した場合、サルコペニアにおいてカルニチン欠乏者は筋力低下が認められているが、筋肉量が保持されているダイナペニアでは有意な関連は認められませんでした10)。 これらの結果から、サルコペニアの状態にある心不全患者では筋力低下の規定因子として、カルニチン不足が寄与している可能性があり、カルニチンによる介入はさらなる筋力低下を防ぎ、心不全患者のQOLや予後の改善も期待できると考えられます。
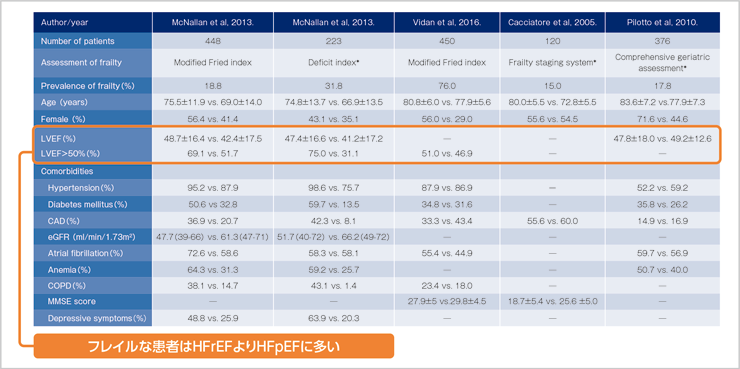
表1:心不全患者におけるフレイル合併と非合併の比較
*:A high score was defined as frail,whereas a low score was defined as non-frail.
Reproduced from [Heart, Kinugasa Y et al, 103, 184-9, 2017]
with permission from BMJ Publishing Group Ltd.
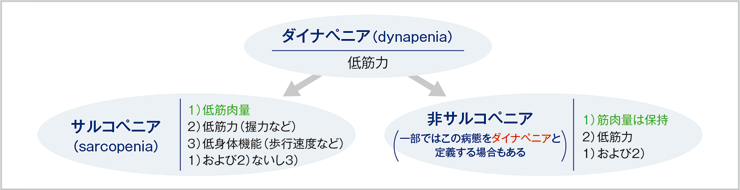
図1:筋力低下の概念:サルコペニアとダイナぺニア
山本先生 作成
心不全と尿酸の関わり
久留先生
次に私から、心不全に合併する高尿酸血症の機序や介入のあり方について解説します。はじめに、わが国の『高尿酸血症・痛風の治療ガイドライン(第3版)』11)の治療アルゴリズムでは、無症候性高尿酸血症で心不全を合併する場合には、血清尿酸値8.0 mg/dL以上での介入が示されています。ただ、CQをみると、腎障害を有する場合に尿酸降下薬の使用が推奨されている一方、心不全を有する場合の使用についてはエビデンスが不足しており、記載はありません。
心不全ではNYHA心機能分類の悪化とともに血清尿酸値が上昇しますが12)、その機序としてはインスリン抵抗性の獲得、心拍出量低下による腎血流量の低下、さらに利尿薬使用も関係していると考えられます(図2)13)。心不全患者ではキサンチンオキシダーゼが活性化され、組織の虚血でATPが分解されて尿酸産生過剰となることも推測されていますが、この経路を証明した研究は今のところなく、基本的には尿酸排泄低下型が多いと考えられています。
また、心不全患者においては血清尿酸値が10 mg/dLを超えるときわめて生存率が悪化することが報告されています14)。最近の研究15)でも、HFpEFでEF50%以上、BNP 100 pg/mL以上、NT-proBNP 400 pg/mL以上の291例を解析して、血清尿酸値が8.3 mg/dLを超える場合はそれ以下の尿酸値の方に比べて生存率が悪化しており、尿酸降下薬の使用により血清尿酸値が年間1.0 mg/dL以上低下した群では、低下しなかった群に比べて予後が良好であったことが報告されています。
先ほどご紹介したわが国のガイドライン11)では、推奨を検討するにあたり、高尿酸血症合併心不全患者における尿酸降下薬介入による心血管死亡の減少について2件のRCTを採用しましたが、いずれも薬物介入、プラセボ群間で有意な差は認められませんでした。NYHA心機能分類 Ⅲの心不全患者にオキシプリノールを投与したOPT-CHF研究16)では、血清尿酸値は平均6.2 mg/dLまで低下したものの、心血管疾患の死亡、入院、心不全入院の改善を認めませんでした。しかしながら、同研究のサブ解析で、血清尿酸値9.5 mg/dL以上の群では全死亡、心血管死の減少傾向、臨床症状の改善が認められていました。そこでEXACT-HF研究17)は、血清尿酸値9.5 mg/dL以上の心不全患者にアロプリノールを投与して、血清尿酸値は平均11.0 mg/dLから6.7 mg/dLまで低下していたものの、総死亡や再入院などで差は認められませんでした。この2つの研究結果から、「高尿酸血症合併心不全患者に対して、生命予後改善を目的とした尿酸降下薬の投与は積極的には推奨できない」とガイドライン11)で結論づけられています。
しかし、本邦で行われたFREED研究18)では、高血圧、2型糖尿病、腎臓病の存在、または脳心血管疾患の既往のある患者を対象として、フェブキソスタット群では脳・心・腎血管障害からなる複合エンドポイントが有意に改善していました。その背景として、フェブキソスタット群では腎機能低下が抑制されており、心腎連関を介した心血管イベント抑制の目的においては、尿酸降下薬を使用するのも1つの選択肢となると考えられます。

図2:慢性心不全における高尿酸血症の機序
文献13)より引用
今後の検討課題
久留先生
ここからは山本先生とともに、高尿酸血症合併の心不全患者への介入のあり方について考えていきたいと思います。
現時点でわが国のガイドライン11)では、生命予後に関するエビデンスがないため心不全合併高尿酸血症に積極的な介入は推奨していません。ただしこれまで、アロプリノールが心不全のサロゲートマーカーであるFMDを改善することは、数々のメタ解析で確認されています。山本先生は心不全患者の高尿酸血症に関して、どうアプローチすべきとお考えですか。
山本先生
高齢化が進むなか、治療においてはハードエンドポイントのみならずQOL改善を重視する傾向にあります。われわれの研究で運動耐容能を評価しているのも、そうした背景があってのことです。呼吸筋トレーニングでFMDが改善すると生命予後は変わらなくても運動耐容能が改善するのかなども含め、まずはFMDの位置づけを明らかにすることが重要と考えています。
久留先生
また、心不全患者に限りませんが、血清尿酸値が高くフレイルを起こしている高齢者にプリン体制限を行うと、栄養障害によるフレイルの悪化も懸念されます。そのような病態では、尿酸降下薬によるアプローチも必要と思います。
山本先生
そうですね。一律に食事制限を行うことの弊害も踏まえ、介入方法は個々に検討する必要があります。心不全患者ではobesity paradoxの現象が指摘されており、痩せている患者ではまず食べる指導が行われています。そのなかでもし血清尿酸値が上がってきたときに、食事内容を細かく制限するのか、制限せずに食べながら尿酸降下薬で下げるほうがよいのか、そこは個々患者のポリファーマシーの状況によっても違ってくると思います。
久留先生
先ほどのFREED研究の結果などを踏まえ、尿酸降下薬に腎保護作用があると仮定して、心腎連関で腎臓を保護する重要性についてはどのようにお考えですか。
山本先生
心腎連関は昔から言われていますが、心不全患者を対象としたDAPA-HFのサブ解析19)などでも示されているように、SGLT2阻害薬は、投与直後にみられるeGFRのinitial drop後のeGFR低下速度を緩やかとし、結果的に腎保護と心不全イベントの低下をもたらしました。こうした結果から、腎保護がその後の心不全イベントの抑制に効いている可能性があり、腎保護効果のある薬剤による介入については検討の余地があると思います。
久留先生
では実際に、心不全に合併する高尿酸血症に対する具体的な管理のあり方について考えたいと思います。
まず、利尿薬とβ遮断薬、降圧薬使用時の血清尿酸値の上昇は痛風のリスクとなるため、適切な薬剤選択が重要であることは昔から言われています。関連するガイドラインに目を向けると、『急性・慢性心不全診療ガイドライン(2017年改訂版)』20)では、血清尿酸値7.0 mg/dLを超える痛風患者と8.0 mg/dL以上で合併症を有する患者においては生活指導後の薬物治療を考慮し、明確なエビデンスはないものの7.0 mg/dL以下を目標にすることが妥当と示されています。『エビデンスに基づくCKD診療ガイドライン2023』21)では、保存期CKDで高尿酸血症を有する患者の場合、尿酸低下療法は腎機能の悪化を抑制する可能性があり、行うことを考慮してもよいという見解です。『2020年改訂版 不整脈薬物治療ガイドライン』22)では、尿酸が心房細動のリスクマーカーと示されつつ、介入に関する具体的な記載はありません。『肥満症診療ガイドライン2022』23)では、痛風や痛風結節のある患者においては、血清尿酸値を6.0 mg/dL以下に維持することが望ましく(Grade A、Level Ⅱ)、『高血圧治療ガイドライン2019』24)では6・7・8ルール(コントロール目標は6.0 mg/dL以下、高尿酸血症の診断基準は7.0 mg/dL超、薬物療法検討の目安は8.0 mg/dL以上)のもと血清尿酸値6.0 mg/dL以下を管理目標とすることなどが示されています。
そこで、心不全に合併する高尿酸血症への薬剤選択を考えると、まず、GLP-1受容体作動薬に比べてSGLT2阻害薬は新規痛風発症率を強く抑制するという報告があります25)。Dual-energy CTを用いた研究では、尿酸降下薬をすでに投与されている痛風患者にフェブキソスタットを投与し、血清尿酸値が6.5 mg/dLから4.2 mg/dLまで低下すると尿酸結晶(MSU)が減少することが証明されており26)、やはり6.0 mg/dL以下を目標とすることが適切です。
一方、無症候性高尿酸血症の場合、臓器保護などの観点からどこまで下げるかのコンセンサスはありません。先生はその点についてどのようにお考えですか。
山本先生
心不全の予後に直接的には結び付けられませんから、一般的に血清尿酸値が高いことの悪影響を考えた場合、SGLT2阻害薬が心不全の基本治療薬に入ってきたなかで、SGLT2阻害薬のみで血清尿酸値のコントロールが可能な場合もありますが、どこに治療目標値を置くかで尿酸降下薬使用場面も変わってきます。また、尿酸のもつ抗酸化作用を鑑み、血清尿酸値の下げ過ぎにも注意を払う必要があると思います。
久留先生
そうですね。無症候性高尿酸血症で生活習慣病や臓器障害を合併する場合、やはりガイドライン11)が示すように6・7・8ルールで治療を行うことが基本となるかと思います。
本日は心不全診療の権威である山本先生とともに、心不全の病態、特にHFpEFを中心として筋力や運動耐容能の問題も含め、詳しく解説をいただきました。そのなかでやはり心不全と尿酸との接点は多く、マーカーかリスク因子かの問題をはじめ、どこまで血清尿酸値を下げればよいのか、また痛風患者への栄養指導がフレイルの抑制にもたらす影響も含めて慎重に考えていく必要があると理解できました。
さらに昨今は、SGLT2阻害薬、ARNIなど血清尿酸値の低下が期待できる心不全治療薬も登場しており、それらと尿酸降下薬をどのように使用していくかのエビデンスを得ることも今後の課題になるかと思います。
本日は長時間、どうもありがとうございました。
山本先生
こちらこそありがとうございました。
References
1) Zhang L,et al.ESC Heart Fail.2023;10:1996-2009.
2) Mamas MA,et al.Eur J Heart Fail.2017;19:1095-104.
3) Edelmann F,et al.Clin Res Cardiol.2011;100:755-64.
4) Hamada T,et al.ESC Heart Fail.2021;8:2876-88.
5) Tanaka S,et al.J Card Fail.2018;24:723-32.
6) Kinugasa Y,et al.Eur J Prev Cardiol.2018;25:1785-6.
7) Kinugasa Y,et al.J Card Fail.2020;26:1022-3.
8) Dempsey JA,et al.Respir Physiol Neurobiol.2006;151:242-50.
9) 『カルニチン欠乏症の診断・治療指針 2018』改正WGカルニチン欠乏症の診断・治療指針2018. https://www.jpeds.or.jp/uploads/files/20181207_shishin.pdf(閲覧:2023-11-13)
10) Kinugasa Y,et al.Geriatr Gerontol Int.2023;23:524-30.
11) 日本痛風・核酸代謝学会ガイドライン改訂委員会(編).高尿酸血症・痛風の治療ガイドライン第3版(2019年改訂).東京:診断と治療社;2018.
12) Ogino K,et al.Circ Heart Fail.2010;3:73-81.
13) 宮崎聡,他.Heart View.2014;18:1170-5.
14) Anker SD, et al. Circulation. 2003;107:1991-7.
15) Nishino M,et al.J Am Heart Assoc.2022;11:e026301.
16) Hare JM,et al.J Am Coll Cardiol.2008;51:2301-9.
17) Givertz MM,et al.Circulation.2015;131:1763-71.
18) Kojima S,et al.Eur Heart J.2019;40:1778-86.
19) Jhund PS,et al.Circulation.2021;143:298-309.
20) 日本循環器病学会/日本心不全学会合同ガイドライン.急性・慢性心不全診療ガイドライン(2017年改訂版).http://www.j-circ.or.jp/cms/wp-content/uploads/2017/06/JCS2017_tsutsui_h.pdf(閲覧:2023-9-27)
21) 日本腎臓学会(編).エビデンスに基づくCKD診療ガイドライン2023.東京:東京医学社;2023.
22) 日本循環器学会/日本不整脈心電学会合同ガイドライン.2020年改訂版 不整脈薬物治療ガイドライン.http://www.j-circ.or.jp/cms/wp-content/uploads/2020/01/JCS2020_Ono.pdf(閲覧:2023-9-27)
23) 日本肥満学会(編).肥満症診療ガイドライン2022.東京:ライフサイエンス出版;2022.
24) 日本高血圧学会高血圧治療ガイドライン作成委員会(編).高血圧治療ガイドライン2019.東京:ライフサイエンス出版;2019.
25) Fralick M,et al.Ann Intern Med.2020;172:186-94.
26) Shen M,et al.Clin Rheumatol.2018;37:3107-13.




久留先生
本日は「高尿酸血症と心不全」をテーマに、心不全診療のエキスパートである山本先生と対談を行いたいと思います。まずは山本先生、心不全の疫学と基本的な治療指針について解説をお願いします。