

肥満と尿酸
肥満と血清尿酸値の関連性
肥満、肥満症とメタボリックシンドローム
GLにおけるメタボリックシンドロームの治療の考え方
久留先生
高尿酸血症患者は8割が肥満、高血圧、脂質異常症、耐糖能異常を重複して合併しており2)3)、メタボリックドミノの概念においても、生活習慣の乱れが肥満をきたし、肥満からインスリン抵抗性を生じてドミノ倒しのように合併症を引き起こし、そのなかに高尿酸血症も含まれることが示されています4)。
実際、内臓脂肪面積と血清尿酸値の間には有意な正の相関があり5)、内臓脂肪の蓄積はインスリン抵抗性を介し、尿酸排泄低下型の高尿酸血症を引き起こすと考えられます。これは高インスリン血症が近位尿細管にあるNa+モノカルボン酸共輸送体SMCT1を活性化し、ナトリウムの再吸収促進による食塩感受性高血圧を起こすと同時に、尿酸トランスポーターURAT1をも活性化して尿酸の再吸収を亢進し、排泄低下型高尿酸血症を引き起こす機序として説明できます6)。
GL2)では生活習慣病に合併した高尿酸血症治療はまずは生活習慣病の管理を優先させ、合併症の治療が必要な場合は尿酸代謝に好ましい生活習慣病治療薬を使用しますが、それでも血清尿酸値が8.0mg/dL以上である場合は、6.0mg/dLを目標として尿酸降下薬の投与を開始します(図1)。
高尿酸血症の病型分類を行う際には随時尿を用い、尿中尿酸濃度/尿中クレアチニン濃度(UUA/UCr)比<0.5であれば尿酸排泄低下型、UUA/UCr>0.5であれば尿酸産生過剰型あるいは腎外排泄低下型として、尿酸排泄促進薬と尿酸生成抑制薬を選択することが可能です(図2)6)。さきほど、内臓脂肪の蓄積があると排泄低下型高尿酸血症が合併する機序を述べましたが、実際の治療を考える際には血清尿酸値そのものを抑えるのか、尿酸産生過程でのキサンチン酸化還元酵素(XOR)活性に着目すべきなのかも問題となります。
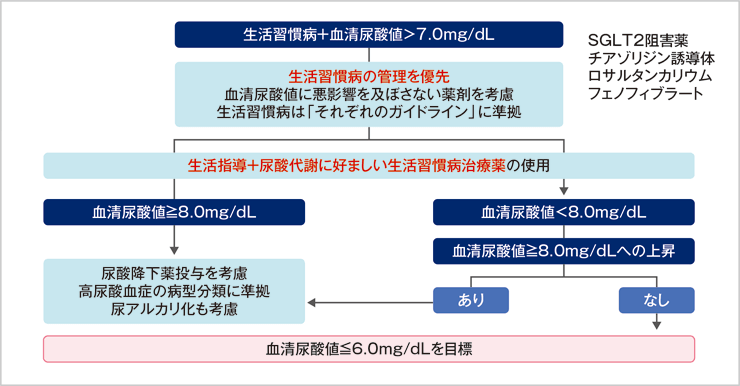
図1:生活習慣病に合併した高尿酸血症の治療
・生活習慣の修正、特にカロリー制限と飲酒制限が重要である。
・生活習慣病治療薬の選択に関しては、尿酸値を上昇させない薬物療法を優先する。
・高尿酸血症は腎障害や心血管イベント発症と関連することが示唆されていることから、尿酸管理に配慮した
生活習慣病診療が必要である。
久留先生 作成
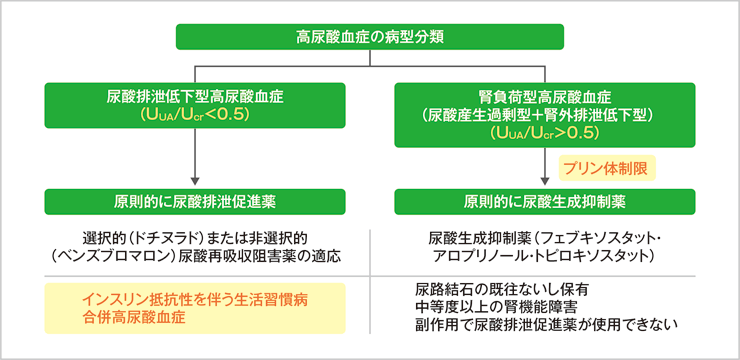
図2:一般的な尿酸降下薬の選択
久留先生 作図
高尿酸血症と合併症の発症機序
久留先生
5年間の追跡調査の結果から、合併症のない高尿酸血症は高血圧、脂質異常症、慢性腎臓病(CKD)、肥満の発症と有意に関連し、糖尿病も有意な傾向を示したことが明らかとなっています7)。なぜこのように尿酸が臓器障害を起こすのかに着目すると、マウスを用いた検討では多くの臓器と同様、脂肪細胞においてはURAT1、URATv1、ABCG2、MRP4、MCT9などの尿酸トランスポーターが発現しています8)。そのため、細胞外が高尿酸血症状態になるとURATv1やURAT1を介して尿酸が細胞内に取り込まれ、酸化ストレス増加によりアディポサイトカインの分泌異常を起こすと考えられました。
そこでわれわれはインスリン抵抗性を有する心不全合併高尿酸血症に対し、URAT1とURATv1を遮断するベンズブロマロンを投与したところ、プラセボ群に比べ悪玉アディポサイトカインである腫瘍壊死因子-α(TNF-α)が有意に減少し、血清尿酸値低下との間に有意な正の相関が認められました9)。つまり高尿酸血症が脂肪細胞に作用して、多くの生活習慣病を引き起こす可能性があると考えられました。
さらにわれわれは血清尿酸値の上昇が脂肪肝の発症リスクとなることも報告していますが10)、これは尿酸そのものが尿酸トランスポーターのメカニズムを介して脂肪肝を起こし、脂肪肝が逸脱酵素としてXORを放出して臓器障害を惹起するためと考えられます。
ではここから引き続き、西澤先生のお考えを聞かせてください。
肥満やインスリン抵抗性など代謝異常における血漿中XOR活性高値の役割
高尿酸血症と合併頻度の高い肝疾患との関連
西澤先生
高尿酸血症はその合併症とされるCKDに関しては早期介入による効果が期待されていますが、心血管疾患(CVD)に関しては一貫した介入研究の成果は得られていません11)(図3)。それは高尿酸血症とは1つの表現型であり、その病態には遺伝素因や内臓脂肪蓄積などの環境因子がかかわるheterogeneousなものであることに起因していると考えられ、1人の患者さんにおいてもこれらの成因が複合して関与していることが多いです。
われわれは2008年、健診受診者を対象として内臓脂肪面積の増減と血清尿酸値の相関を報告しており12)、当初、脂肪組織そのものが高尿酸血症に関与することを考えました。そこでXORに着目したところ、XORの発現はマウスでは脂肪組織で豊富ですが13)、ヒトでは主に肝臓と小腸への分布に限定されていました14)。ヒト、マウスのいずれも肥満の脂肪組織においてはプリンde novo合成が亢進しており、マウスの脂肪組織からは尿酸13)、ヒトの脂肪組織からはヒポキサンチンとして分泌されており14)、脂肪組織のプリン合成化代謝亢進により血清尿酸値が上昇する機序が考えられました。
XORはまず、脱水素型酵素であるキサンチン脱水素酵素(XDH)として細胞内で産生されますが、虚血下での低酸素状態などの病的状況や血液中などの細胞外では酸化型酵素であるキサンチン酸化酵素(XO)に変換され、このXOが代謝の過程で活性酸素(ROS)を産生することが、臓器障害の病態を形成するといわれています15)16)。
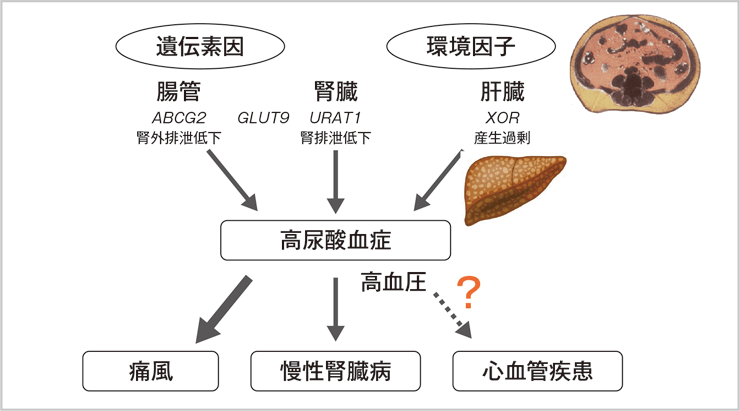
図3:高尿酸血症の病態
ABCG2:ATP-binding cassette transporter G2
GLUT9:glucose transporter9
URAT1:urate transporter 1
西澤均,他.痛風と尿酸・核酸.2023.(in press)より引用
2型糖尿病、肥満手術患者におけるXOR活性変化と肝酵素変化の関連の検討
西澤先生
血中XOR活性の規定因子は盛んに探索されていますが、われわれの検討では2型糖尿病患者の血漿XOR活性は健常者より高く、上下幅が顕著でした17)。そこで各臨床パラメータとの相関を多変量解析にて検討したところ、アスパラギン酸アミノトランスフェラーゼ(AST)、アラニンアミノトランスフェラーゼ(ALT)との強い相関を認めました17)。
さらに、われわれは高度肥満症患者の減量手術前後の血漿XOR活性の変化と臨床パラメータの相関について検討したところ、BMIよりもASTと強く相関していました18)。また、ASTが30〜40IU/Lを超える非アルコール性脂肪性肝疾患(NAFLD)病態で血中XOR活性は指数関数的に増加することを見出しました18)。
マウスを用いた実験において、NAFLD/非アルコール性脂肪肝炎(NASH)病態の進行に伴い、血中XOR活性の顕著な上昇とともに頸動脈結紮後の新生内膜増殖の亢進が認められ、XOR阻害薬であるトピロキソスタット投与により新生内膜増殖が抑制されることがわかりました18)。
これらの一連の結果から、われわれはNAFLD/NASHの病態では血中にXORが放出され、血管局所でヒポキサンチンをキサンチン、尿酸へと変換させていく過程の酸化ストレスが内皮機能障害と血管平滑筋細胞の増殖をもたらして動脈硬化を惹起させる可能性を考えています。
血漿中XOR活性高値による病態への臨床的介入
西澤先生
このような病態の進展抑止にはXOR阻害薬による過剰な血中XORの抑制が有効と考えられます。BEYOND- UA studyでは、高血圧症を合併する高尿酸血症患者135例をトピロキソスタット投与群とフェブキソスタット投与群に無作為に割り付け、24週間観察したところ、主要評価項目である心臓足首血管指数(CAVI)の変化は認められませんでしたが19)、肝機能高値群と低値群に分類したサブ解析では、トピロキソスタット投与群においてALT高値群で有意なCAVIの改善が認められました20)。同様に、ALT高値群では有意な脈波伝播速度(baPWV)の改善が認められています20)。
高尿酸血症には、腎・腸管での尿酸排泄低下型と、肝でのXORを介した尿酸産生過剰型の病態があります。高尿酸血症は痛風の原因ですが、腎障害や特に動脈硬化性疾患の関連は十分に明らかではありません。ただ、われわれの検討からXOR活性はNAFLD/NASHの血漿中で著明に上昇し、動脈硬化症、特に細動脈硬化の病態に関与している可能性が考えられます。よって、NAFLD/NASHを成因とする高尿酸血症はXOR阻害薬によって抗動脈硬化性の作用を期待できる可能性があると考えています。
肥満による高尿酸血症の管理の考え方
久留先生
ありがとうございます。まず、先生方の臨床研究でASTが30〜40IU/Lを超えると肝臓からXORが指数関数的に放出される機序はどのようにお考えですか。
西澤先生
証明できてはいませんが、おそらくAST、ALTと同じように、血中への過剰な逸脱があるのだと考えています。分泌機構を介すにしては分子が大きすぎることと、実験的にも現時点では肝細胞から分泌される現象は見出せておりません。
久留先生
また、BEYOND-UA studyのサブ解析で、XOR活性が上がっているであろうALT高値群ではトピロキソスタット投与でCAVIやbaPWVの改善が認められましたが、フェブキソスタット群ではどうだったのでしょうか。
西澤先生
今回の検討のフェブキソスタット群では、ベースラインのばらつきが多く検討できておりません。今回見出した効果がXOR阻害薬としてのクラスエフェクトか、compound specificなのかは非常に重要な問題であり、現在異なるstudyで検討中です。
久留先生
また、今日の先生のお話から肥満による高尿酸血症の管理ターゲットとして、いわゆる細動脈硬化を合併するようなNAFLD/NASHにはトピロキソスタットのようなXOR阻害薬の有用性が期待できることがわかりました。XORのさまざまな病的意義を考えると、XOR活性の抑制は血管の内皮機能、血流依存性血管拡張反応(FMD)、微量アルブミン尿、推算糸球体濾過量(eGFR)など臓器障害の改善にも効果が期待できるのでしょうか。
西澤先生
そこは今まさに研究を始めたところですが、やはり血管内皮と平滑筋に対する作用はあると思っています。
慢性臓器障害の重要なターゲットと考えているのは心不全です。心不全の病態と血漿XOR活性が関係しているのか、AST、ALTで分けたときに差がつくのかは、今後解明していくべきテーマと捉えています。
久留先生
非常に面白いと思います。肝機能障害をもっている高尿酸血症の心不全、虚血性腎症のような細動脈硬化の病態に対し、XOR活性を抑制する薬剤が推奨できると証明されれば、世の中の考え方は全く変わってくると思います。
西澤先生
そうですね。AST、ALT高値の脂肪肝であれば、XOR阻害薬による臓器保護効果が期待できる可能性もあると考えています。
久留先生
最後に、高尿酸血症の治療について先生のご意見をお伺いします。先生のお話からは尿酸をターゲットとする病態と、XORをしっかり抑えるべき病態、おそらく2つの局面があり、オーバーラップもしていると思いますが、薬剤の使い分けについてお考えはありますでしょうか。
西澤先生
痛風の治療においては、まずは治療目標である血清尿酸値6.0mg/dL以下に到達することが重要です。尿酸トランスポーターの遺伝素因による関与が強い病態では、尿酸排泄促進薬が血清尿酸値をシャープに低下させることについては皆さん異論がないと思いますので、痛風を起こすような遺伝素因の強い病態は相対的に尿酸排泄促進薬が優先されると思います。一方、今回お示ししたような内臓脂肪蓄積を基盤にしたNAFLD/NASHを伴う高尿酸血症であればXOR阻害薬が推奨されるのではないかと思います。実地臨床では両病態が混在している例もあると思います。そういう症例においては、XOR阻害薬と尿酸排泄促進薬の併用も考慮されると思います。
久留先生
高尿酸血症患者における尿酸降下薬の使い分けは昔からの命題ですが、簡易法が提案されながらも病型分類は一向に浸透していません。やはり尿酸降下薬も一般の生活習慣病の治療の考え方にならい、患者さんの病態、合併症による使い分けが望ましく、それにより高尿酸血症、痛風、生活習慣病の治療においてさらに普及していく可能性があると思いました。その観点からも、本日の先生のお話は非常に有意義だと感じました。
ぜひ今後も研究を発展させ、高尿酸血症と臓器障害との関係を解明して、私たちに新しい指針を与えていただきたいと思います。本日はどうもありがとうございました。
西澤先生
こちらこそ、ありがとうございました。
References
1) 日本肥満学会(編).肥満症診療ガイドライン2022.東京:ライフサイエンス出版;2022.
2) 日本痛風・核酸代謝学会ガイドライン改訂委員会(編).高尿酸血症・痛風の治療ガイドライン第3版(2019年改訂).東京:診断と治療社;2018.
3) 細谷龍男.日内会誌.2001;90:1877-82.
4) 久留一郎.診断と治療.2022;110:813-8.
5) Takahashi S,et al.Metabolism.1997;46:1162-5.
6) 久留一郎.Dr.ヒサトメのかかりつけ医のための高尿酸血症・痛風診療Q&A.東京:診断と治療社;2021.
7) Kuwabara M,et al.Hypertension.2017;69:1036-44.
8) Maharani N,et al.Int Heart J.2016;57:395-9.
9) Ogino K,et al.Circ Heart Fail.2010;3:73-81.
10) Jensen T,et al.Sci Rep.2018;8:11735.
11) Nishizawa H,et al.Hypertens Res.2022;45:635-40.
12) Tamba S,et al.Intern Med.2008;47:1175-80.
13) Tsushima Y,et al.J Biol Chem.2013;288:27138-49.
14) Nagao H,et al.Obesity(Silver Spring).2018;26:1168-78.
15) Battelli MG,et al.Biochim Biophys Acta.2014;1842:1502-17.
16) Kelley EE.Pharmacol Rep.2015;67:669-74.
17) Kawachi Y,et al.J Diabetes Investig.2021;12:1512–20.
18) Kawachi Y,et al.JCI Insight.2021;6:e144762.
19) Kario K,et al.J Clin Hypertens(Greenwich).2021;23:334-44.
20) Fujishima Y,et al.Biomedicines.2023;11:674.




久留先生
本日は肥満と核酸代謝に関し意欲的な研究を進めておられる西澤均先生をお迎えし、「肥満と尿酸」をテーマに最新の話題をお伺いしたいと思います。
まず肥満症の定義としては、ボディマス指数(BMI)25以上かつ11種の健康障害(合併症)の1つ以上か内臓脂肪型肥満がある場合、そしてメタボリックシンドロームの定義としては、内臓脂肪蓄積があり、脂質異常[トリグリセライド値≧150mg/dLかつ/またはHDL-C値<40mg/dL(男女とも)]、血圧高値(収縮期血圧≧130mmHgかつ/または拡張期血圧≧85mmHg)、高血糖(空腹時血糖値≧110mg/dL)の3項目のうち2項目以上を満たす場合とされています1)。そして肥満症の場合の減量目標は、現体重の3%以上、高度肥満症の場合は5〜10%と設定されています。ただ、『高尿酸血症・痛風の治療ガイドライン第3版(2019年改訂)』(GL)2)では、減量により血清尿酸値が低下し、痛風発作の頻度も減少しますが、急激な減量は血清尿酸値を上げ発作を誘発する危険性があるため、緩徐に減量することが重要と示されています。