座談会
痛風・高尿酸血症の
治療意義~腎の病態進展防止~
各先生のご所属等は掲載当時のものです。
各先生のご所属等は掲載当時のものです。


痛風・高尿酸血症の有病者はとても多く、生活習慣の変化や高齢化に伴う合併症も増加し、各病態に応じた治療が求められています。本座談会では、高尿酸血症治療の意義、血清尿酸値6.0mg/dL以下にコントロールする重要性、およびその際の薬剤選択を中心にお話しいただきます。
古波蔵先生
腎機能低下におよぼす高尿酸血症のリスクは知られていますが、アロプリノールを投与したCKD患者さんの予後が改善しなかった研究もあり、CKD患者さんにおける高尿酸血症の治療意義がやや曖昧になっていると思います。わが国の透析導入率は男性が増加する一方、女性では横ばいから減少に転じています4)。また、肥満・痛風は男性のみ増加していますので、肥満、メタボリック症候群(以下、メタボ)、高尿酸血症が男性におけるCKDのリスクに関与している可能性があります。
高尿酸血症は尿酸塩の析出による痛風腎やシュウ酸カルシウム析出の促進によるカルシウム結石のリスク上昇を介してCKD進展に関連すると考えられています。痛風腎で透析になる症例はほとんど経験がありませんが、最近の研究では痛風患者さんの約3割、腎生検を受けたCKDステージ3・4患者さんだと16%程度がエコーで髄質の石灰化を認めました。したがって、典型的な痛風腎でなくても、潜在的に尿酸塩結晶が腎障害の進展にかかわっていることが示唆されます。
一方、尿酸塩結晶を介した機序以外に、高尿酸血症自体が輸入細動脈硬化症を惹起し高血圧との相互作用を介して糸球体高血圧や虚血といった糸球体血行動態異常を引き起こすことで腎障害進展にかかわる可能性も示唆されています。こういった尿酸塩dependentな病態と糸球体血行動態dependentな病態の両者が相まって、腎障害の進展にかかわることが推察されます。
尿酸塩による腎障害の進展機序を考えた場合は血清尿酸値をしっかり下げることが重要である一方,血行動態異常を介した病態機序に対しては高血圧に対する降圧治療と併せて考える。この2つの軸で考えることが重要だと考えます。血清尿酸値をしっかりコントロールするという意味では選択的尿酸再吸収阻害薬(SURI)はABCG2を抑制しないため、より効果的に血清尿酸値を下げる新たな選択肢として、その意義があると思われます。
肥満、メタボの腎障害とのかかわりでは、若年者では血清尿酸値とCKD発生リスクは肥満者でのみ有意でした5)。一方、中壮年期では、肥満があろうとなかろうと関係がある。肥満、メタボの人が尿酸塩の病態とともに糸球体高血圧の絡みでCKDあるいは蛋白尿の出現にかかわる一方、中壮年期以降では同時期から多くなる高血圧による腎障害の増悪因子として肥満の有無にかかわりなくCKDに関連してくる可能性があると考えられます。すなわち肥満、メタボの患者では糸球体高血圧による蛋白尿の増加を介して、一方で肥満の合併がない患者では高血圧や加齢による腎硬化症(一般的に蛋白尿があまり出ない)に関連した虚血の増悪因子として高尿酸血症が重要な役割を演じている可能性があります。
以上から、糸球体高血圧主体の病態下では尿酸値自体より厳格な降圧管理がより重要だと考えられます。一方で腎硬化症を背景とした潜在的な虚血の病態下では、尿酸降下薬により腎障害の進展が抑制されたことが報告されており、尿酸降下薬による腎保護が期待できる可能性があります。
藏城先生
古波蔵先生の研究6)では、CKDステージ3患者さんのサブグループ解析でeGFRが30~45の群よりも45~60の群のほうがフェブキソスタットがよりeGFRの低下抑制に対して有効でした。この機序に関してどうお考えでしょうか。
古波蔵先生
われわれが最近報告した前向き介入試験では、CKDステージ3の方を対象にフェブキソスタットとベンズブロマロンのeGFR低下に対する影響を比較していますが、血清尿酸値の低下度は両群で同程度に6mg/dL未満まで下がっていました。一方、コントロールがないので検討が不十分ですが、蛋白尿(アルブミン尿)の改善程度は、従来の報告同様に有意差は出ませんでしたが、一方でeGFR45~60の群と同様に300mg/gCr未満の蛋白尿が乏しい方でフェブキソスタットの投与がより低下抑制に有効である傾向がみられました。われわれのこれらサブグループ別の解析結果はFEATHER studyで示された結果と同様な傾向を示しており、蛋白尿に乏しい腎硬化症のような虚血の背景がある病態下で、XOR(xanthine oxidoreductase、キサンチン酸化還元酵素)活性の阻害自体が腎機能低下抑制に寄与しているのではないかと考察しています。
藏城先生
介入試験で血清尿酸値の管理目標を7.0や6.0mg/dL以下としたものがあまりないのですが、心血管あるいは血管内皮に着目する話をさせていただきます。
心不全患者さんを対象とした試験7)では、血清尿酸値6.0mg/dL程度を境にどのイベント(心血管死、心不全による入院など)でも血清尿酸値が高いほど発生率が高くなっています。2020年「循環器病対策推進基本計画」では、循環器疾患をいかに治療・予防していくかという意味で、循環器疾患に至る高血圧、脂質異常症、糖尿病、慢性腎臓病といった重要な生活習慣病に高尿酸血症も掲げられました8)。循環器病に高尿酸血症が絡んでいるのではないか、介入が必要なのではないかということを示しています。
動脈硬化あるいは心血管における尿酸塩結晶に着目する研究が、2020年以降出てきています。まずはin vivoにおける検討で、尿酸塩結晶あるいはカルシウムが血管に沿ってどれぐらい沈着しているのか調べたものです9)。図39)に示したように、心臓の冠動脈、上行/下行の胸部大動脈の緑色のところです。下行の腹部大動脈や腸骨動脈にカルシウム沈着があり、尿酸塩結晶も沈着しています。これが何か悪さをするかは証明できていないと思いますが、尿酸塩結晶は腎臓や関節以外、血管の中にも沈着しているのではないかという論文です。
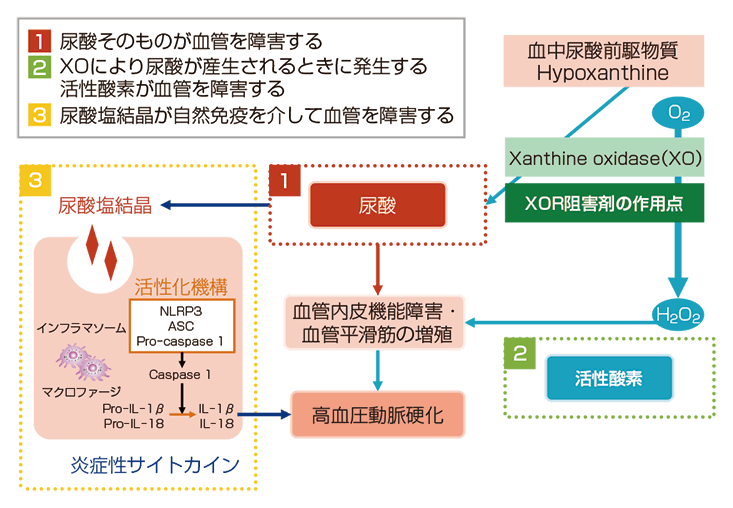
高尿酸血症が血管内皮機能障害を引き起こすメカニズムとして、3つ考えられています。1つ目は尿酸そのものが血管を障害するというもの。2つ目は、XORを介した活性酸素が血管内皮機能障害を引き起こすというものです。3つ目は、尿酸塩結晶が血管内でインフラマソームの刺激、あるいは自然免疫を介して炎症を惹起し、その炎症が高血圧の動脈硬化を、すなわち血管内皮機能障害等をもたらすのではないかと示唆されています(図4)。
もちろん、第1の機序における血清尿酸値そのものを下げようと思えば、尿酸排泄促進薬あるいは尿酸生成抑制薬、どちらでも有効と思います。一方で、第2の機序はXOR活性を阻害する尿酸生成抑制薬の投与がよいのではないかと思います。また第3の機序については、痛風の結節では血清尿酸値が下がるほど痛風の結節が縮小する、あるいは痛風の予防になることがわかっています。心血管においても何らかの影響があるのではないかと示唆されています。尿酸排泄促進薬あるいは尿酸生成抑制薬のどちらでも、血清尿酸値を下げる点では有効だと思います。
血清尿酸値の管理目標は各ガイドラインで次のように記載されています。
管理目標は心血管における介入について比較した論文がないので、6.0mg/dL以下を目指すといったところは言いにくいかもしれませんが、尿酸塩結晶が関与していると思われる血管内皮においては6.0mg/dL以下ということは合理性がより強く言える可能性があると思っています。
先に述べた3つの機序は個々に独立してではなく、複合的に血管内皮機能障害に関与すると考えられています。まだ十分なエビデンスがありませんが、治療目標としては、無症候性高尿酸血症でCKDなどの合併病態があるような症例では8.0mg/dL以上から尿酸降下薬の投与を考慮し、6.0mg/dL以下を目指すというものです。
図3: 痛風患者の異なる血管領域におけるDECTによるMSU結晶沈着像(in vivo)
ATA:上行胸部大動脈、DAA:下行腹部大動脈、DECT:dual-energyCT、DTA:下行胸部大動脈、MSU:尿酸一ナトリウム。
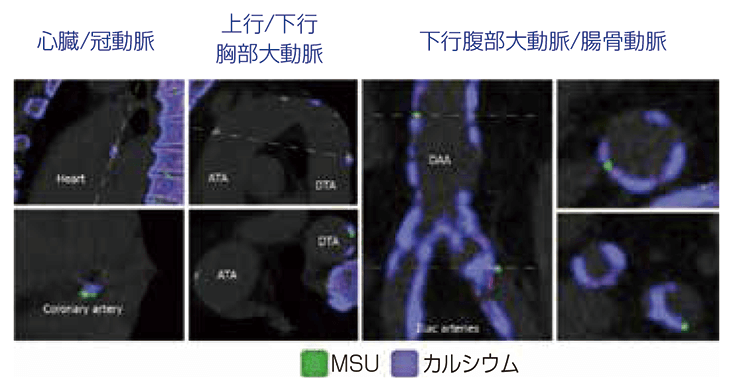
(文献9より)
図4: 高尿酸血症が血管内皮機能障害を引き起こすメカニズム
寺脇先生
次に、患者さんの個別性についてお伺いしたいと思います。たとえば、20歳代で痛風関節炎を繰り返していて肥満だが高血圧やCKDになっていない人と、50歳代でやせていて痛風関節炎はそう頻回ではないけれども、CKDなどを伴っている人では選ぶべき治療戦略が変わってくると思います。また、女性と男性でも違いがあるのかもしれません。このあたりをどう思われますか。
古波蔵先生
肥満、メタボの背景のある方は潜在的に痛風のリスクも高い。また酸性尿を呈していて、腎臓の中でも尿酸塩の析出が懸念される。そういった方では、血清尿酸値を6mg/dL以下にするという厳格な管理が非常に重要だろうと思います。一方で、そういった方では尿酸生成抑制薬だけでは管理が難しい場合もあります。それは背景として、高インスリン血症などによる尿酸の再吸収が非常に亢進して、腎への排泄が低下している。その腎への排泄という部分にアプローチできないと、しっかり血清尿酸値を下げるのは難しいだろうと思います。SURIなどの尿酸再吸収を抑えて尿酸排泄を促進するような薬を適宜使っていくことが重要視されると思います。
一方、中高年以降、高血圧などもあってCKDステージが進むと、細動脈硬化も進んできますので、血管内皮障害の観点からも活性酸素種を産生するXOR活性を抑える。必ずしも肥満・メタボがないような方では、このほうが理に適っているのではないかと思っています。
寺脇先生
先生のお話をお伺いして、尿酸が腎臓に再吸収されることをしっかり抑制して血清尿酸値を厳格に下げるSURIと、血管内皮機能を守る力が強い尿酸生成抑制薬という立ち位置がみえてきたような気がします。
藏城先生
CKDの予防、血管内皮、心疾患に対する現状のエビデンスには尿酸生成抑制薬が用いられているので、とくに心血管イベントのリスクが高くそれを防止する、CKDといった病態においては尿酸生成抑制薬を選択するのがよいのではないかと思います。
しかし肥満の患者さんではとくにインスリン抵抗性があって産生過剰のほうにも傾くのですが、排泄低下によって尿酸生成抑制薬では十分管理できないようなケースを多々経験します。そのような症例では、現状であればSURIのユリス®の投与を考えるべきだと思います。
寺脇先生
ドチヌラド(ユリス®)は、私自身もかなりの症例に使って論文を投稿中ですが、高尿酸血症以外の腎機能増悪リスクがないような症例では、ドチヌラド(ユリス®)による腎保護性が高い印象を受けており、腎保護に関するポテンシャルが期待されます。その一方で、尿酸排泄促進薬は尿路結石のリスクが懸念されると思います。尿路結石の対策として、尿アルカリ化の必要性について、どのようにお考えでしょうか。
古波蔵先生
尿酸排泄促進薬で一時的に尿中への尿酸排泄が増えますが、結果的に尿酸プール(体内の尿酸量はおよそ一定に保たれていること)全体が下がり、血清尿酸値が十分下がってくると、尿酸排泄が高い状態が続くわけではありません。尿路結石症診療ガイドライン12)に推奨されるレベル以下になりますので、ドチヌラド(ユリス®)は添付文書上も尿路結石を伴う患者さんが必ずしも禁忌になっていない背景でもあるかと思います。尿酸プールが下がるということが逆に尿路結石の懸念も払拭してくれます。
その意味では、尿のアルカリ化は必須ではないかもしれませんが、やはり肥満、メタボの方の酸性尿は、結石以外にも管理する意義があるのではないかと考えて、アルカリ化をするようにしています。
藏城先生
尿酸排泄促進薬を投与すると、尿酸の排泄量が投与直後に上がってきて、血中の過剰な尿酸が速やかに排泄されるフェーズである1週間あたりから少し減っていくというデータがみられます。おそらく体内の尿酸プールが減ることで、尿酸排泄も減るのだろうと思っています。
尿酸排泄促進薬を投与することにより、排泄低下によって血清尿酸値が高くなっている状態を元に戻す、健常な状態にするという考え方では、投与初期における尿アルカリ化薬の使用は望ましいと思われます。一方、長期的な面からすると、健常な尿酸プールに戻ると考えれば、もしかしたら不要なのではないかと思っています。
ただし、高尿酸血症で酸性尿になっているのは痛風、尿路結石のリスクになるので、アルカリ化薬の投与が推奨されています。
それから、ユリス®の開発のデータ、市販直後調査からみると、尿路結石が増えたといったデータはあまりみてとれず、報告はあまりありません。われわれ自身もベンズブロマロンを過去に使ってきて、実際に大規模なデータで尿路結石の増減に関する研究報告がなく、実臨床でも増えたという経験はほとんどありません。ですから、ユリス®も尿路結石にこれまで以上の注意はいらないのではないかという印象を持っています。
古波蔵先生
尿酸生成抑制薬は内皮機能障害の観点からもやはり重要かと思います。一方で、それ自体の尿酸トランスポーターへの影響から尿酸排泄を阻害するため、増量しても直線的に血清尿酸値が下がるかというと、意外と下がりづらい。その背景に、やはりトランスポーターへの影響という部分で、投与量を増やすほど尿酸がうまく出ていかないというジレンマがあって、血清尿酸値をしっかり下げるという観点では、尿酸排泄促進薬を併用せざるを得ない方も多いのだと、最近実感しています。
寺脇先生
やはり第一義に血清尿酸値をしっかりターゲットまで下げるということがあって、そのために必要に応じて両者の併用をしていくお考えですね。私もまったく同じ考えです。
寺脇先生
尿酸生成抑制薬ですが、いま使えるのは3種類、アロプリノール、フェブキソスタット、トピロキソスタットです。この中での使い分け、選択の仕方など、原則のようなものをお持ちでしたら教えてください。
古波蔵先生
アロプリノールは腎機能障害例で代謝物の蓄積等の観点から使いづらい部分もあります。新規の尿酸生成抑制薬、フェブキソスタット、トピロキソスタットの使用頻度が高い状況です。
トピロキソスタットに関してはアルブミン尿の改善効果に関していくつか報告があり、蛋白尿やアルブミン尿が出ている患者では優先的に使用してみてそれらの改善効果を確認することを実臨床の現場で行ったりもします。
寺脇先生
なお、単純な血清尿酸値に加えて、XOR活性(XO活性)が臓器障害、血管障害に寄与している可能性に関しても、今後検討していくべき課題なのではないかと思います。
古波蔵先生
XO活性と蛋白尿との関連を検討されていたら教えてください。
寺脇先生
手持ちのデータから蛋白尿減少効果ともっとも強い関係があると思われるのは、トピロキソスタットだと思います。以前フェブキソスタットとトピロキソスタットとの間で蛋白尿への影響を比較したのですが、トピロキソスタットのほうが有意に強い蛋白尿抑制が得られておりました13)。同じ尿酸生成抑制薬でも、XOに及ぼす影響は違っている可能性はあるかと思います。
藏城先生
尿酸生成抑制薬の使い分け、選択の仕方については、私も古波蔵先生と同様で追加することはありません。
寺脇先生
CARES研究14)において、アロプリノール投与群と比較してフェブキソスタット投与群で心血管疾患の発症リスクが高いというデータが出ました。しかしこれは、このあと出てきたFREED研究15)の結果などをふまえますと、フェブキソスタットとアロプリノールの「どれだけ血管リスクを増やすかの比較」ではなく、おそらくは逆に「どれだけ血管リスクを軽減できるかの比較」の結果を見ている可能性が高いのではないかと思われます。このあたりの実状について実地医家の先生方にも広くご認識いただき、血清尿酸値を下げる尿酸生成抑制薬が、基本的に血管障害を減らすことはあっても増やすことはないとご了解いただければと思います。
古波蔵先生
高尿酸血症に対する治療介入は、ターゲットを意識することが重要と思います。肥満、メタボの方では尿酸塩結晶が痛風に加えて腎臓の尿細管間質障害にもかかわってきます。尿酸塩を結晶化させない、できたものを溶解するという点で、「尿酸塩結晶を溶かすために血清尿酸値をガイドラインの推奨に従って6mg/dL未満に下げる」といった意識が重要だと思います。
一方で、痛風、メタボがない方は、血清尿酸値が上がっている背景として、腎小細動脈硬化症に関連した排泄低下が背景にあり、蛋白尿の有無で糸球体高血圧主体の病態と虚血主体の病態をある程度見極めることが重要だと考えられます。私見にはなりますが先ほどお話しした知見を踏まえ、蛋白尿に乏しく虚血主体の病態が想定される場面では、尿酸生成抑制薬であるXOR阻害薬を選択するのも手ではないかと思います。
経験的に言いますと、そういう血行動態機序を介した症例は、尿酸生成抑制薬投与後、次の外来で意外とeGFRが改善していたり、比較的早くその使用意義がわかる印象があります。患者さんごとの治療反応、血清尿酸値の低下だけでなくeGFRへの影響もみながら、患者さんごとに意義づけること、背景病態を考慮した個別化という視点が非常に重要だろうと思います。
藏城先生
高尿酸血症の心血管のリスクとなる(想定される)機序は3つあることは先に述べました。高尿酸血症を認めた場合は、やはり治療介入を積極的に考えていただければと思います。どのように治療していくかというと、古波蔵先生がおっしゃったように、やはり個別化、患者さんの病態に応じた治療が非常に重要になってきます。実地医家の先生でそこまで行うのは難しいケースでは、やはり血管リスクを下げるという点で、まずはトピロキソスタット、尿酸生成抑制薬がファーストでよいのかもしれません。
そのような治療を行っていただき、どうしても血清尿酸値の管理が難しいような場合、尿酸排泄促進薬を併用するというのが、実地医家の先生にとっては、やりやすい治療方法の1つではないかと思っております。
寺脇先生
今日は先生方から、本当に多くのことを教えていただきました。本日の座談会から得られたメッセージとして実地医家の先生方に強調したいのは、高尿酸血症は単に痛風関節炎の予備軍というだけではなく、臓器障害・メタボリックドミノの中核的な存在であり、痛風関節炎がなくなった症例であっても、少なくとも臓器を守るためには血清尿酸値を6.0mg/dL以下にする―とくに女性であればさらに低めにコントロールしていただきたい―ということです。
先生方には痛風関節炎の向こう側にある患者さんの長生きのために、ぜひ血清尿酸値に注目していただき、そして腎機能を含む全身状態に目を向けていただくと、まったく違った臨床状況がみえてくるのではないかと思います。
References
1)Kawashima M, et al.:Association between asymptomatic hyperuricemia and new-onset chronic kidney disease in Japanese male workers:a long-term retrospective cohort study. BMC Nephrol 12:31, 2011
2)日本痛風・尿酸核酸学会 ガイドライン改訂委員会(編): 高尿酸血症・痛風の治療ガイドライン 第3版.診断と治療社,2018
3)Koto R, et al.:Real-world treatment of gout and asymptomatic hyperuricemia:A cross-sectional study of Japanese health insurance claims data. Mod Rheumatol 31:261-269, 2020
4)井関邦敏,他:沖縄県における透析療法50年史(1971~2020年).日本透析医学会雑誌 55:627-633,2022
5)Kuma A, et al. : Development of chronic kidney disease influenced by serum urate and body mass index based on young-to-middle- aged Japanese men:a propensity score-matched cohort study. BMJ Open 12:e049540, 2022
6)Kohagura K, et al.:Urate‒lowering drugs for chronic kidney disease with asymptomatic hyperuricemia and hypertension:a randomized trial. J Hypertens 41:1420-1428, 2023
7)Selvaraj S, et al.:Serum uric acid, influence of sacubitril-valsartan, and cardiovascular outcomes in heart failure with preserved ejection fraction:PARAGON-HF. Eur J Heart Fail 22:2093- 2101, 2020
8)厚生労働省:循環器病対策推進基本計画.[https://www. mhlw.go.jp/content/10905000/000688415.pdf]
9)Barazani SH, et al.:Quantification of uric acid in vasculature of patients with gout using dual-energy computed tomography. World J Radiol 12:184-194, 2020
10)日本腎臓学会(編):エビデンスに基づくCKD 診療ガイドライン 2023.東京医学社,2023
11)FitzGerald JD, et al.:2020 American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res(Hoboken)72:744-760, 2020
12)日本泌尿器科学会,他(編):尿路結石症診療ガイドライン 第2版.金原出版,2013
13)Terawaki H, et al.:Effect of switching xanthine oxidoreductaseinhibitor from febuxostat to topiroxostat on urinary protein excretion. Clin Exp Nephrol 21:356-357, 2017
14)White BB, et al.:Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N Engl J Med 378:1200-1210, 2018
15)Kojima S, et al.:Febuxostat for cerebral and cardiorenovascularevents prevention study. Eur Heart 40:1778-1786, 2019
寺脇先生
尿酸には抗酸化能というよい面があります。具体的には、ヒト科の血清尿酸値は高値であり、それに伴って長寿という恩恵がもたらされています。一方で、過剰な尿酸は痛風関節炎の原因物質となります。食事など生活習慣の変化に伴い高尿酸血症を発症母体とする痛風関節炎の患者数は今や125万人を超え、高尿酸血症を呈する方は1,000万人を超えていると推計されています。
一方、高尿酸血症は慢性腎臓病(CKD)の発症母体の1つでもあります。われわれの検討1)では、高尿酸血症(血清尿酸値>7.0mg/dL)におけるCKD新規発症の点推定ハザード比は3.99、すなわち約4倍でした。高血圧のハザード比は2.00でしたので、高尿酸血症は高血圧の2倍のリスクがあるといえる結果でした。
図12)に高尿酸血症に関する現行の治療指針を示します。高尿酸血症は「痛風関節炎または痛風結節がなく血清尿酸値が8.0mg/dL未満の場合」と「痛風関節炎または痛風結節がなく腎機能が正常で、血清尿酸値が9.0mg/dL未満の場合」を除いてすべてが薬物治療の対象であり、介入後の血清尿酸値は6.0mg/dL以下が推奨されています。
しかしながら、実際の治療状況を調べた研究によると、血清尿酸値6.0mg/dL以下の達成率が低いことが報告されています(図2)3)。その背景には、単に「痛風関節炎が起こらなければよい」という視点が関与しているのではないかと推察されます。
このような実状を踏まえ、痛風、高尿酸血症治療と腎機能低下の進展抑制、そして高尿酸血症という状況が腎生存率など腎に与える影響について、古波蔵先生からお願いいたします。
図1: 高尿酸血症・痛風の治療指針
(文献 2 より)
図2: 高尿酸血症の治療状況
(文献3より)