座談会
高尿酸血症治療の
NewStandardを考える。
各先生のご所属等は掲載当時のものです。
各先生のご所属等は掲載当時のものです。

わが国では高尿酸血症患者さんが経年的に増加し、国民生活基礎調査の結果1)から推定される有病者数は1,000万人以上、痛風患者さんは125万人にも上り、common diseaseとなってきました。こうしたなか、近年では尿酸降下薬の開発が相次ぎ、新しい基礎的・臨床的な知見が集積されています。
日本痛風・核酸代謝学会(現、日本痛風・尿酸核酸学会)作成の『高尿酸血症・痛風の治療ガイドライン第3版』(以下、高尿酸血症・痛風ガイドライン)において、血清尿酸値7.0mg/dL超の無症候性高尿酸血症では、合併症を有する場合に血清尿酸値8.0mg/dL以上から生活指導および薬物治療の適応となり、現時点で得られているエビデンスや薬物の副作用について情報を患者さんに示し納得のうえで開始することが望ましいとされています2)。また、2020年10月に『健康寿命の延伸等を図るための脳卒中、心臓病その他の循環器病に係る対策に関する基本法』に基づき策定された循環器病対策推進基本計画3)では、循環器病に至る生活習慣病として高尿酸血症が高血圧や脂質異常症、糖尿病、慢性腎臓病(CKD)などと併記され、循環器病を予防するという観点からも高尿酸血症治療が重要視されるようになりました。
本日は、このような現状を踏まえ、無症候性高尿酸血症に対する尿酸降下薬の使い分けについて、私と高尿酸血症治療に精通しておられる3名の先生方でディスカッションしていきたいと思います。
久留 一郎
市田先生
ヒトの体内尿酸プールは成人男性で約1,200mgであり、食事由来のプリン体摂取を含めて1日に約700mgの尿酸が産生されて尿酸プールに入りますが、毎日尿中へ約500mg、腸管などの腎外へ約200mgが排泄されます。産生量と同量の尿酸が体外へ排泄されることで尿酸プールは一定量に維持されており2)、このバランスが崩れたときに高尿酸血症をきたします。高尿酸血症は病態によって、尿酸排泄低下型、腎負荷型(尿酸産生過剰型、腎外排泄低下型)と、これらを併せもつ混合型に分類されます(図1)2)。
現在わが国で使用可能な尿酸降下薬は、尿酸生成抑制薬、尿酸排泄促進薬、および選択的尿酸再吸収阻害薬(SURI)に分類されます。最近では、尿酸生成抑制薬として非プリン型キサンチン酸化還元酵素(XOR)阻害薬のフェブキソスタットが2011年に、トピロキソスタットが2013年に発売されました。さらに2020年にはSURIとしてドチヌラドが発売され、治療薬の選択肢が広がりました。SURIは、既存の尿酸排泄促進薬に比して腎臓の近位尿細管の管腔側の尿酸再吸収トランスポーターSLC22A12/URAT1を選択的かつ強力に阻害します4)。
基本的には、先ほど紹介した病型分類を踏まえたうえで、それぞれの問題点を是正する薬剤を選択するのが理にかなっていると思います。ただし、高尿酸血症・痛風ガイドライン2)では、最近の尿酸降下薬は非常に作用が強くなって病型による使い分けを行わなくても血清尿酸値を低下させることができるため、病型によって薬剤を選択するという推奨はなくなりました。しかし、論理的には問題点を是正すれば尿酸動態と血清尿酸値は正常に戻るわけですから、その患者さんの問題点を是正する薬剤、たとえば尿酸排泄低下型であれば尿酸排泄促進薬を、尿酸産生過剰型であれば尿酸生成抑制薬を選択するのが基本だと考えます。
図1: 高尿酸血症の病態の分類
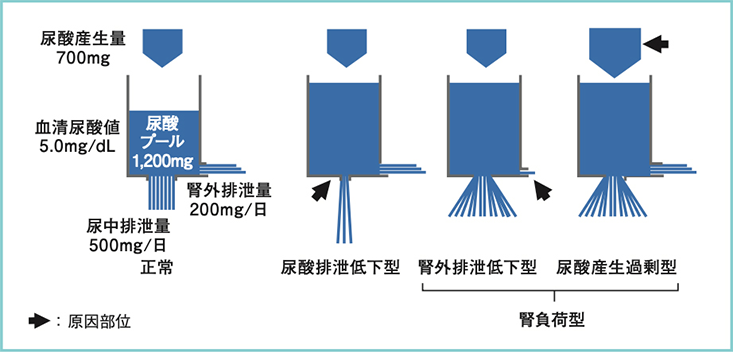
(文献2)より引用,改変)
久留先生
私も病型分類による使い分けに賛成ですが、CKDや心不全などの合併症をもつ患者さんに対しても病型分類に基づく考え方を当てはめてよいものか悩むところではあります。寺脇先生、腎臓専門医のお立場からコメントはございますか。
寺脇先生
市田先生がおっしゃるとおり、血清尿酸値を直接的に低下させる目的であれば尿酸排泄促進薬を、尿酸再吸収亢進型であればドチヌラドを、尿酸産生過剰型であれば尿酸生成抑制薬を選択するということになるかと思いますが、合併症についてはそれとはまた別の軸で考えるべきではないかと思っています。実際、高尿酸血症(血清尿酸値>7.0mg/dL)を有する場合、CKDの新規発症リスクは約4倍になることがわかっています(表1)5)。また、XOR阻害薬の投与によってCKD患者さんにおける心血管イベントが有意に抑制された(p=0.0434、対応のないt検定 or χ2検定)というデータがあります6)。しかも興味深いのは、血清尿酸値自体はイベント発現との関連がなかったことです(表2)6)。以上より、臓器保護を念頭に置いてXOR阻害薬を選択するのも実臨床的には有用ではないかと考えます。血清尿酸値を低下させるという目的に加えて、合併症も薬剤選択の基準として捉えるべきではないでしょうか。
表1: CKD新規発症のリスク因子としての高尿酸血症
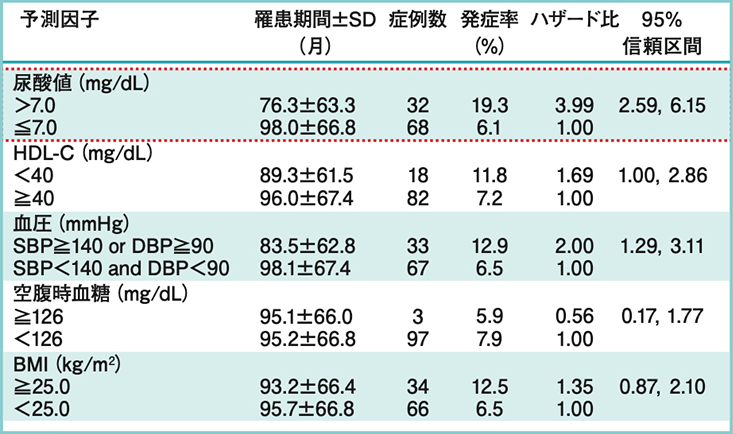
HDL-C:high-density lipoprotein cholesterol,SBP:systolic blood pressure,DBP:diastolic blood pressure (文献5)より引用)
表2: Gonryo study(イベント抑制)
心血管イベントリスクと死亡要因
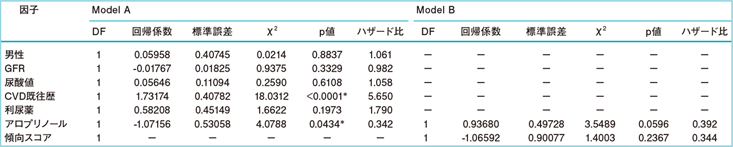
GFR : glomerular filtration rate, CVD : cardiovascular disease
年齢、性別、GFR、血圧、尿酸値、CVD既往歴、脂質異常症、糖尿病、利尿薬および腎保護降圧薬[アンジオテンシン変換酵
素阻害薬(ACEI)および/またはアンジオテンシン受容体拮抗薬(ARB)]の使用状況から算出
*:p<0.05
久留先生
非常に重要な点をご指摘いただいたと思います。
ところで、新たに発売されたドチヌラドはその薬理作用によって特に投与初期に尿酸排泄量が増大することから、尿が酸性の場合には尿路結石およびこれに由来する血尿や腎仙痛などを防止するために水分摂取による尿量の増加と尿のアルカリ化を図る必要があります7)。藏城先生、尿路管理の観点からご意見はありますか。
藏城先生
高尿酸血症では尿酸排泄低下型の特徴をもつ症例が9割を占めるため、尿酸排泄促進作用を示すドチヌラドを選択することは合理的といえます。一方、全体の3割は混合型であり、尿酸産生過剰型の特徴を併せもつ症例に尿酸排泄促進作用を示す薬剤を使用すると尿路結石のリスクが高まります2)。われわれのデータでも肥満の患者さんは尿酸産生が増加することがわかっています8)ので、混合型に対してはXOR阻害薬をはじめとした尿酸生成抑制薬を選択するのが望ましいと思います。また、病型の見極めが難しい場合は、尿酸生成抑制薬を選択するほうが尿路管理の面からもよいのではないかと思っています。
市田先生
従来の病型分類に基づく薬剤選択では混合型に対しては尿酸生成抑制薬の選択が基本となりますので、純粋な尿酸排泄低下型の患者さんにのみ尿酸排泄促進薬を選択して、それ以外はXOR阻害薬をはじめとした尿酸生成抑制薬を選択するというのが病型分類による薬剤選択の基本になると思います。また尿路管理の観点から、高尿酸血症・痛風の患者さんに対しては1日2L以上の尿量を確保するよう指導しています。これは、尿酸排泄促進薬およびSURIの使用によって一時的に尿中への尿酸排泄量が増えた場合の対策につながります。特にドチヌラドは、尿量の確保や尿pHのコントロールなどの尿路管理を徹底したうえでの使用が求められます。
久留先生
ありがとうございました。今お話しいただいたとおり、新規薬剤の登場により病型に沿った薬剤選択が可能となってきていますが、今後の課題としては実臨床の先生方には十分にそのことが浸透していないことがあると思います。今後病型に沿った薬剤選択が見直され、実臨床にも浸透していくことが期待されますね。
久留先生
病型により薬剤を使い分ける方法は尿酸コントロールには適していますが、合併症の問題に関しては患者さんのプロファイルに基づいていかに治療していくかを考える必要があると思います。そこで、合併症、特にCKDに関して寺脇先生はどのようにお考えでしょうか。
寺脇先生
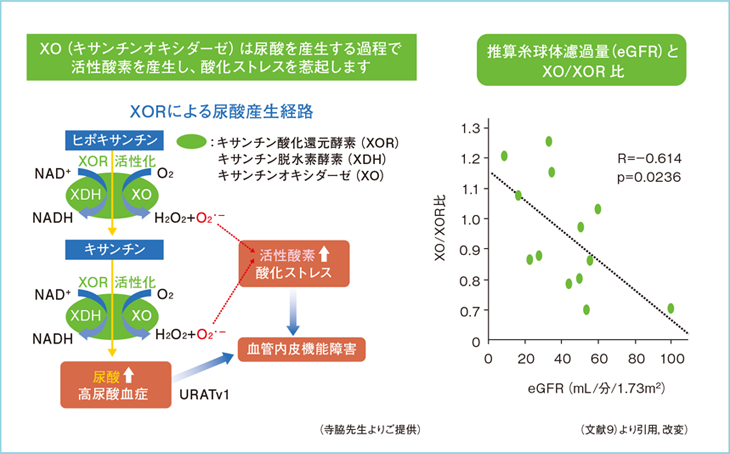
XORは肝細胞内のような還元的状況ではそのほとんどが活性酸素を発生しないキサンチン脱水素酵素(XDH)として存在することが知られていますが、血漿では逆に活性酸素を発生するキサンチンオキシダーゼ(XO)のほうが多く、しかも腎機能低下に伴ってXOR中のXOの比率が上昇することが示されていますので(図2)9)、血管を保護するという観点でXOR阻害薬を選択するのが基本ではないかと思います。
ただし、CKDといっても高尿酸血症以外のCKDリスクはなく超音波でも皮髄境界におけるエコー輝度上昇が確認されるような明らかな痛風腎の症例では、比較的早い段階でドチヌラドを投与すると腎機能が改善することをしばしば経験するので、痛風腎はCKDのなかでもSURIが適しているのではないかと思っています。
エビデンスベース9)では、CKD症例や心血管イベントがある症例にはまずXOR阻害薬を選択するのがよいのではないかと考えられます。そして、痛風腎はCKDのなかでもSURIが適しているのではないかと思っています。一方内皮機能という観点から、CKDで微量アルブミン尿が出ている患者さんには血漿中のXO阻害活性が強いXOR阻害薬を優先するのがよいのではないかと考えています。
実際、XOR阻害薬を臓器別に比較したところ、内皮細胞における活性を反映している血漿中のXOR活性に対してはフェブキソスタットとトピロキソスタットの阻害効果に差がある(p<0.001、t検定)ことが確認されました10)。肝臓や腎臓ではXORのほとんどがXDHで存在するため、フェブキソスタットとトピロキソスタットの効果に差はありませんでしたが、XOの比率が高い血漿ではフェブキソスタットの効果は発揮されにくく、効果に差が出たのではないかと推察しています10)。
図2: CKD患者におけるeGFRとXO/XOR比との関係
久留先生
わかりました。さて、尿酸・尿酸塩結晶による高血圧および動脈硬化の発症機序としては、尿酸そのものが血管障害を起こす、XOによる尿酸産生時に発生する活性酸素が血管を障害する、尿酸塩結晶が自然免疫を介して血管を障害する、という3つの機序が考えられます(図3)11)。そのなかで尿酸トランスポーターを介した可溶性尿酸の血管障害、ならびに尿酸塩結晶による自然免疫を介した血管障害の機序は、尿酸降下薬によって正常化される可能性があります。
XOにより尿酸産生時に発生する活性酸素が血管を障害するというのは循環血液中のXOR活性を介した血管障害機序であり、XOR阻害薬の重要性が示唆されます。高尿酸血症患者さんを対象とした後ろ向き観察研究では、トピロキソスタットにより血清尿酸値が有意に低下し(p<0.001、対応のあるt検定)、血管内皮機能の評価指標であるFMD(flow-mediated dilatation)が有意に増加する(p=0.045、対応のあるt検定)ことが示されています(図4)12)。
藏城先生、インスリン抵抗性の観点からはどのように使い分ければよいとお考えでしょうか。
図3: 尿酸ならびに尿酸塩結晶による高血圧・動脈硬化の発症機序
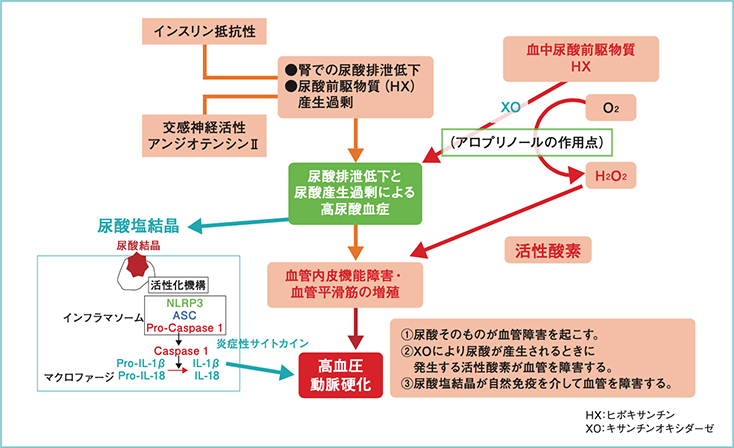
(文献2)11)より作図)
図4: トピロキソスタット投与8週後における血清尿酸値およびFMDの変化
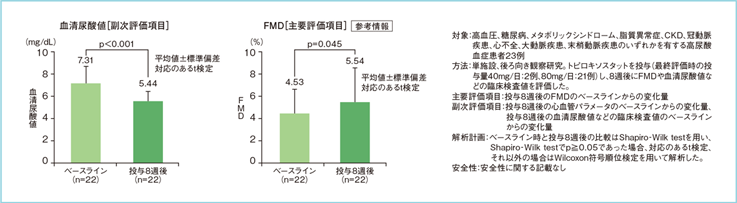
(文献12)より作図)
藏城先生
肥満の患者さんは、インスリン抵抗性が基盤にあることによって尿酸再吸収亢進および産生過剰という両方の作用をきたすのではないかと考えています。そういう意味では尿酸排泄促進薬を選択するのもよいとは思いますが、どうしても尿酸産生過剰を合併することが多いので、XOR阻害薬を先に投与するほうが合併症の予防という観点からもよいと思っています。
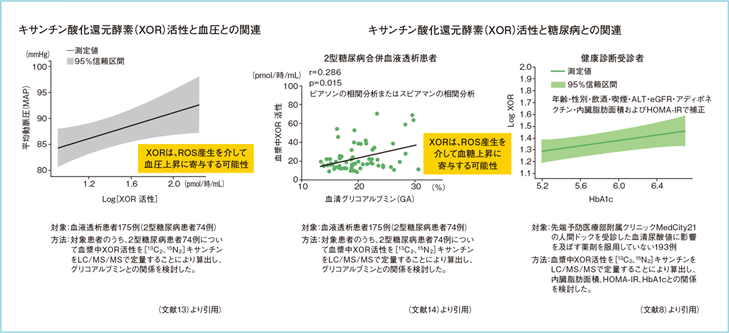
実際私たちは、血漿中のXOR活性が高いほうが血圧および血糖コントロール指標[血清グリコアルブミン(GA)およびHbA1c]が高値であることを見出しました(図5)8)13)14)。ですから、血漿中のXOR活性を十分に抑制できる薬剤のほうが、動脈硬化や糖代謝、場合によっては心血管イベントも抑制できると考えています。したがって、血漿中のXORを十分に抑制するトピロキソスタット10)は理にかなったXOR阻害薬ではないかと考えています。
図5: XOR活性と血圧・糖尿病との関連
久留先生
そうですね。肥満や脂肪肝となると肝臓から逸脱酵素として血漿XORが放出されて血液中を循環して、特に内皮細胞に結合するとそこで活性酸素を産生し、血管内皮障害や微量アルブミン尿に関連してくると考えられます。そのため、血漿XOR活性は血管障害に特に関わってきます。もちろんインスリン抵抗性にも関わっているので、血漿XOR活性を確実に抑制する薬剤が臓器保護にとって有用であり、血漿XOR活性と血管保護の観点から使い分けができるのではないかと考えています。
市田先生はXOR阻害薬の基礎的な使い分けについてどのようにお考えですか。
市田先生
XOR阻害薬の血中消失半減期に違い15)-17)があり、その差が影響してトピロキソスタットのほうが血漿中XORを抑制するのではないかと考えています。
久留先生
トピロキソスタットは1日2回朝夕の経口投与により24時間安定した尿酸値が得られることから、高尿酸血症をコントロールしやすいという特徴があります16)。ただし、最近では多くの先生方が1日1回投与の薬剤を好まれる傾向があるように思います。しかし、確実にXORをブロックすることが尿酸のコントロールに加えて臓器保護の観点からも重要ですので、トピロキソスタットの1日2回投与というのは非常に合理的な治療戦略だと考えています。
脳血管障害、心血管障害を合併した痛風患者さんを対象としたCARES研究18)やGonryo研究19)などの結果が報告されてXOR阻害薬の違いが示されていますが、寺脇先生はその差についてどのようにお考えですか。
寺脇先生
おそらくフェブキソスタットもトピロキソスタットもアロプリノールも、どれもアルブミン尿の抑制効果は一定以上ありますが、アルブミン尿抑制効果はそれぞれ異なります。CARES研究でフェブキソスタット群はアロプリノール群に比べて心血管死のリスクが高いことが示され(p=0.002、Cochran-Mantel-Haenszel検定)18)驚きました。おそらくどちらの薬剤も血管保護性はありますが同程度まで血清尿酸値を低下させたときの血管保護性が異なり、血管内皮保護性の差が結果に差を生じさせたのではないかと考えています。つまり、個人的にはCARES研究の結果について、心血管イベントのリスクが増えているのではなくて、リスクリダクションが弱いという現象をみているのではないかと解釈しました。
久留先生
最後に安全性の観点からの薬剤の使い分けについて議論していきたいと思います。
XOR阻害薬は肝機能障害に注意する必要があります。腎機能については、非プリン型XOR阻害薬のフェブキソスタットおよびトピロキソスタット、SURIのドチヌラドは、中等度までの腎機能障害合併例において通常用量での投与が可能です7)16)17)。一方、尿路結石を伴う場合、ドチヌラドは「治療上やむを得ないと判断される場合を除き、投与しないこと」と添付文書に記載されています20)。このような禁忌や慎重投与から薬剤を選択していく方法論について、市田先生はどのようにお考えですか。
市田先生
慎重投与は、裏を返すと臓器障害から考えることと近いものがあると思います。つまり、慎重投与に該当するような肝障害、腎障害を含め、臓器障害を考慮して選択することは非常に重要です。ただし、腎障害を有する患者さんに対しては、尿量の確保や尿pHのコントロールなど尿路管理が徹底できないようであれば、SURIよりはXOR阻害薬を選択するほうがよいのではないかと思います。
久留先生
そうですね。禁忌や慎重投与からみた使い分けは、安全性の観点から重要です。また、病型分類に基づいて混合型にはXOR阻害薬をはじめとした尿酸生成抑制薬を選択するということも含めて、純粋な尿酸排泄低下型、腎負荷型、混合型をうまく分離しながら使い分けていくことが必要になってくると思います。さらに、XOR阻害薬のなかの使い分けについては議論のあるところかとは思いますが、トピロキソスタットは心疾患を有する痛風患者さんでの心血管イベントの懸念につながるような使用成績調査結果が報告されていないことは1つの大きなポイントではないかと思います。これには、血漿XOR活性をブロックする力の差があるのではないかと考えられます。
寺脇先生
最初にどの薬剤を選択するかということは重要ですが、XOR阻害薬もドチヌラドもそれぞれのメリットがありますので、混合型の存在も念頭に置くと場合によっては両者の併用も考えて最終的に安全に尿酸値をコントロールするのが目標になるのではないかと思います。
藏城先生
私も同意見です。肥満の患者さんを対象にした私のデータ8)などから、尿酸産生過剰型と尿酸排泄低下型を合併している患者さんが一定数いるのではないかと考えられます。ですので、まずは尿酸産生を確実に抑制し、それだけでは管理できない場合に尿酸排泄促進薬を併用するという流れが合理的な治療戦略ではないかと現状では考えています。
市田先生
尿酸排泄促進薬で腎臓にある程度負担がかかるという状況だけよりは、尿酸生成抑制薬を併用することによって腎臓への負担も減らすことができるということを考えると、今後、併用療法も注目されていくのではないかと考えています。
藏城先生
XORを抑制することによって活性酸素種(ROS)を抑制するといった機序による心血管イベント抑制も期待できますし、また尿酸そのものの取込みをブロックすることによってさらに動脈硬化に対する保護効果も期待できるかもしれません。尿酸値の管理を容易にする点、結石に対する注意ができる点から、併用療法なども含めて議論をしていく必要があると思っています。
久留先生
よくわかりました。高尿酸血症・痛風の領域では1種類の尿酸降下薬を徐々に増量して目標尿酸値をめざすという理解が広まっており、併用は推奨されないのかという質問をしばしば受けます。高血圧や糖尿病など他の生活習慣病ではそれぞれの合併症や禁忌、慎重投与にあわせてそれぞれを使い分けながらも併用しており、ガイドラインにはどの順番で使用すべきかという推奨が示されています。高尿酸血症・痛風の領域も有用性の高いXOR阻害薬とSURIという2種類の薬剤がありますので、今後、先生方のお知恵を借りながら、他の生活習慣病と同じような薬物治療の“ディシジョンツリー”を併用療法のあり方も含めて作成することができれば、高尿酸血症・痛風の治療がますます安全かつ有効に進展していくのではないかと思います。
本日はどうもありがとうございました。
References
1) 厚生労働省. 2019年国民生活基礎調査 統計表.
(https://www.mhlw.go.jp/toukei/saikin/hw/k-tyosa/k-tyosa19/dl/06.pdf)(閲覧:2021年6月)
2) 日本痛風・核酸代謝学会ガイドライン改訂委員会(編). 高尿酸血症・痛風の治療ガイドライン第3版. 東京:診断と治療社;2018.
3) 厚生労働省. 循環器病対策推進基本計画. 令和2年10月.
(https://www.mhlw.go.jp/content/10905000/000688415.pdf)(閲覧:2021年6月)
4) Taniguchi T, et al. J Pharmacol Exp Ther. 2019; 371: 162-70.
5) Kawashima M, et al. BMC Nephrol. 2011; 12: 31.
6) Terawaki H, et al. Clin Exp Nephrol. 2013; 17: 549-53.
7) 株式会社富士薬品. ユリス®錠インタビューフォーム. 2021年5月改訂(第2版).
8) Kurajoh M, et al. Int J Endocrinol. 2019; 2019: 1762161.
9) Terawaki H, et al. J Clin Exp Nephrol. 2017; 2: 31.
10) Nakamura T, et al. Eur J Pharmacol. 2016; 780: 224-31.
11) 久留一郎.Dr.ヒサトメのかかりつけ医のための高尿酸血症・痛風診療Q&A.東京:診断と治療社;2021.
12) Higa S, et al. J Clin Hypertens (Greenwich). 2019; 21: 1713-20.
13) Yoshida S, et al. Sci Rep. 2020; 10: 4437.
14) Nakatani A, et al. Sci Rep. 2017; 7: 15416.
15) Matsumoto K, et al. J Pharmacol Exp Ther. 2011; 336: 95-103.
16) 株式会社富士薬品. トピロリック®錠インタビューフォーム. 2021年1月改訂(第8版).
17) 帝人ファーマ株式会社. フェブリク®錠添付文書. 2020年12月改訂(第2版).
18) White WB, et al. N Engl J Med. 2018; 378: 1200-10.
19) Watanabe K, et al. PLoS One. 2021; 16: e0249240.
20) 株式会社富士薬品. ユリス®錠添付文書.2021年5月改訂(第3版).
久留先生
まず、病型分類の観点から尿酸降下薬の使い分けについて議論していきたいと思います。市田先生、病型分類からみた使い分けについてどのようにお考えでしょうか。