

高血圧を合併する
高尿酸血症患者に対する治療戦略
高尿酸血症患者は生活習慣病を合併することが多く、高血圧についてもその合併頻度が高いことが知られている。なぜ高尿酸血症には生活習慣病の合併が多いのか、尿酸と血圧はどのような関係にあるのか、高血圧を合併した高尿酸血症患者に対しては具体的にどのような治療を行えばよいのか、本領域のエキスパートにクロストークにてご解説いただいた。
大坪先生
よろしくお願いします。まずは久留先生から高尿酸血症と生活習慣病の合併についてご解説いただき、その後に私から高血圧に的を絞ってお話ししたいと思います。
久留先生
高尿酸血症には
生活習慣病がよく合併する
久留先生
高尿酸血症患者は高頻度に生活習慣病を合併していることがわかっています。健診を受診した30〜59歳の男性 3,996人を対象にした調査において、高尿酸血症837症例では肥満や高血圧、高コレステロール血症、高トリグリセリド血症の合併頻度が全受診者よりも高いことが示されています(図1) 1)。
また、高尿酸血症のみであったのは22.3%に過ぎず、残りの約8割にはほかの生活習慣病が1つあるいは複数合併していたことがわかっています1)。
その要因の1つとして、高インスリン血症の関与が挙げられます。生活習慣病ではインスリン抵抗性により高インスリン血症をきたし、腎臓でのナトリウム再吸収が誘導されます。それと共役して尿酸トランスポーターのURAT1が活性化され、尿酸の再吸収を亢進し、排泄低下型の高尿酸血症をきたす可能性が考えられています。また、その傾向は特に女性で顕著であることが示されています2)。
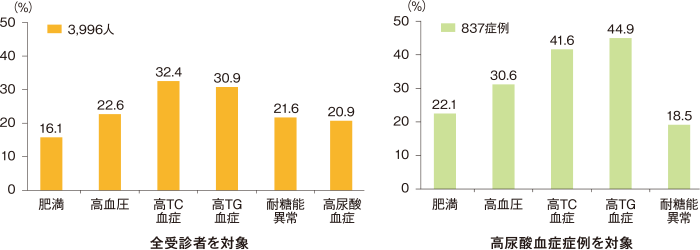

方法:板橋中央総合病院中央検診センターにおける2003年度の男性検診受診者3,996人(30~59歳)を対象に、高尿酸血症837人(血清尿酸値>7.0mg/dL)の生活習慣病合併頻度について調査した。
図1: 高尿酸血症患者における生活習慣病の合併頻度
文献1) より改変・引用
生活習慣病を合併した高尿酸血症の治療戦略を、「高尿酸血症・痛風の治療ガイドライン第3版」(以下、ガイドライン)の内容に基づいてフローチャートにすると、図2のようになります3)。血清尿酸値 7.0mg/dLを超えて生活習慣病を合併している場合、基本的には合併する生活習慣病の管理を優先して血清尿酸値に悪影響を及ぼさない生活習慣病治療薬を使用します。それでも血清尿酸値が8.0mg/dL以上の場合は尿酸降下薬の投与を考慮し、血清尿酸値6.0mg/dL以下を目標にコントロールすることが推奨されています3)。
私の場合は、痛風発症を抑制するエビデンスのある生活習慣病治療薬として、高血圧には長時間作用型カルシウム(Ca)拮抗薬、ロサルタンカリウム、脂質異常症にはフェノフィブラート、糖尿病には SGLT2阻害薬を中心に使用しています4)-6)。
無症候性の高尿酸血症の治療目的は、痛風発作の予防と臓器障害のリスク軽減です。現状では、尿酸降下薬の使用により痛風発症が抑制されるというエビデンスは豊富にありますが、心血管疾患の発症が抑制されるというエビデンスは乏しい状況です。しかし、国内の観察コホート研究において、合併症のない高尿酸血症であっても5年間の追跡で、高血圧や脂質異常症、慢性腎臓病(CKD)、 肥満の累積発症率が尿酸値正常者に比して高くなることが示されています7)。また女性では糖尿病が、男性では 肥満が多く発症するという性差もみられました7)。
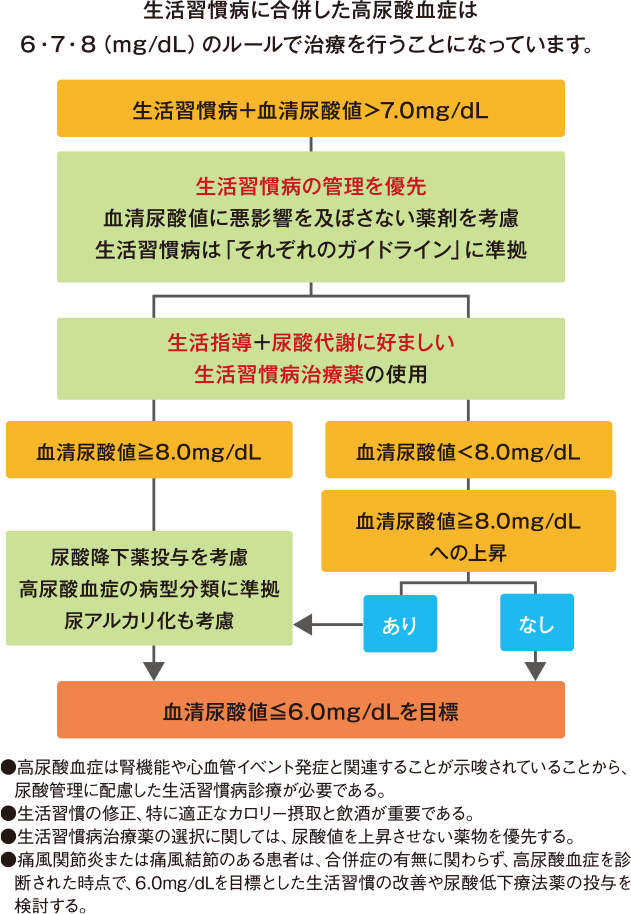
図2: 生活習慣病合併高尿酸血症の治療の流れ
文献3) より作図
ガイドラインでは、「腎障害を有する高尿酸血症の患者に対して、尿酸降下薬は非投薬に比して推奨できるか?」 とのクリニカルクエスチョンに対し、腎機能低下を抑制する目的で尿酸降下薬を用いることを条件付きで推奨しています3)。
一方で、「高尿酸血症合併高血圧患者に対して、尿酸降下薬は非投薬に比して推奨できるか?」については、生命予後ならびに心血管病発症リスクの軽減を目的とした尿酸降下薬の使用は積極的には推奨できないとしています3)。さらに、高尿酸血症合併心不全患者についても同様に、生命予後改善を目的とした尿酸降下薬の使用は積極的には推奨できないとしています3)。
久留先生
高尿酸血症と高血圧はいずれも
血管内皮機能障害を引き起こす
久留先生
大坪先生はこのガイドラインの推奨についてはどのようにお考えですか。
大坪先生
現状では、高血圧や心不全を合併した高尿酸血症患者を対象とした質の高いエビデンスが限定的であることが一因であると思っています。私自身は、高血圧と高尿酸血症はともに血管内皮機能障害を引き起こすことを重視して治療にあたっています。
血管内皮細胞は、血管弛緩因子である一酸化窒素(NO)や過分極因子(EDHF)、また血管収縮因子(EDCF)であるアンジオテンシンⅡやトロンボキサンA2などを産生放出し、血管の緊張を調節しています(図3A) 8)。また、血小板凝縮抑制、抗酸化作用、抗炎症作用などの血管機能の制御も行っています。
高血圧の病態では、発症早期より血管弛緩因子の低下や活性酸素の産生増加がみられ、血管内皮機能障害が認められます。血管内皮機能障害は動脈硬化発症の最初のステップであり、その後の病態の悪化にも大きな影響を与えます(図3B)9)。
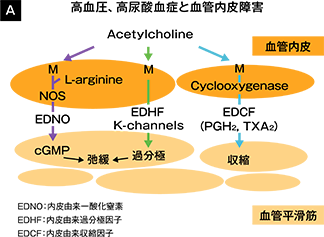
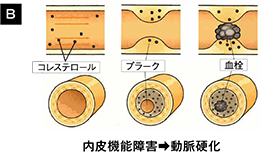
図3: 血管内皮と高血圧
文献8)9)より改変・引用
一方、尿酸は一般的に血液中などでは可溶性の形で存在し抗酸化的に働きますが、組織中などの脂溶性が高い条件下では前酸化物として働きます。血液中の可溶性の尿酸が尿酸トランスポーターURATv1を介して血管内皮細胞内に取り込まれると、活性酸素の産生増加やレニン・アンジオテンシン(RAS)系の活性化、内皮型NO合成酵素(eNOS)の活性低下などを引き起こし、内皮障害から動脈硬化をきたして心血管疾患に関与するという機序が報告されています10)-12)。
そのほかにも、血管内皮細胞にはグリコサミノグリカンを介してキサンチンオキシダーゼ(XO)が常に存在しており、このXOがキサンチンを基質として尿酸と一緒に活性酸素を産生し組織障害を引き起こすなど、いくつかの機序で尿酸は悪玉として働き、さまざまな疾患に関与していると考えられています13)-15)。
実際にヒトにおいて、血流依存性血管拡張反応(FMD)を用いた評価により、高尿酸血症患者では血管内皮機能が障害されていることが報告されています16)-18)。また、アロプリノールによる治療が合併症の有無に関わらず血管内皮機能を改善することが報告されています19)-21)。しかし、対象集団によっては改善を認めないとする報告もあり、今後のさらなる検討が必要です。
久留先生
ありがとうございます。尿酸が高血圧発症の原因になっているかどうかについては、現在どのようなことがわかっていますか。
大坪先生
疫学研究では、観察開始時の血清尿酸高値は後の高血圧発症の独立した危険因子であることが多数報告されています22)-26)。また、血清尿酸値と高血圧の関係は女性や若年者で関連性が強く、高齢になるほど関連性は弱まるとする報告が多いようです27)-31)。
動物実験では、低食塩摂取条件下でウリカーゼの阻害薬であるオキソニン酸を投与して血清尿酸値を高くすると血圧が上昇し、アロプリノールで血清尿酸値を下げると血圧が低下することが報告されており、血清尿酸値と血圧には正の相関関係を認めています32)33)。
ヒトにおいても、血清尿酸値が5.0mg/dL以上で肥満のある11〜17歳の男性20人に、プラセボ、アロプリノール、プロベネシドをそれぞれ2ヵ月間投与すると、収縮期血圧がプラセボ群では1.7mm Hg上昇していたのに対し、アロプリノール群では10.1mm Hg、プロベネシドでは10.2mm Hg低下していました34)。尿酸生成抑制薬と尿酸排泄促進薬のいずれでも同等の血圧低下を認めていることから、尿酸値の低下が血圧の低下につながった可能性が高いと考えられます。
この検討も含め、アロプリノールの投与により血圧が低下するという報告は多数みられ、その傾向は若年者で顕著のようです。
一方で血圧を低下させないという報告もあり、対象集団によって尿酸降下薬の血圧への影響が異なることが考えられます。その背景として、基礎疾患のある高尿酸血症患者では尿酸の血圧への影響がわかりにくいこと、特に高血圧はそれ自体が内皮機能を障害するため、加齢ならびに高血圧の罹病期間が長くなると関連が弱くなることがあるのではないかと考えています。今後、対象集団を明確にした大規模臨床研究の実施による検証が待たれるところです。
久留先生
高血圧合併高尿酸血症患者に
対する治療の実際
久留先生
高血圧専門外来に通院する高血圧患者における高尿酸血症の頻度は、男性で40.6%、女性で8.6%にのぼるという報告があります35)。大坪先生も多くの高血圧合併高尿酸血症患者を診療しておられると思いますが、実際にはどのように治療を進めておられますか。
大坪先生
久留先生がお示しになった図2のとおり、高血圧を合併した高尿酸血症患者に対しては血圧管理を優先します。高尿酸血症が7.0mg/dLを超えれば、血清尿酸値に影響を与えにくい降圧薬を積極的に検討します。アンジオテンシンⅡ受容体拮抗薬(ARB)のロサルタンカリウムはURAT1の阻害により血清尿酸値を低下させる作用を有するため、この薬剤を最初に使用することが多いです。
一方、β遮断薬やαβ遮断薬、ループ系利尿薬、サイアザイド系降圧利尿薬は血清尿酸値を上昇させるため、使用を控えます。痛風発症については、ロサルタンカリウムとCa拮抗薬に発症抑制効果が報告されています(表1)4)。難治性の高血圧は特に血圧管理を優先して行い、利尿薬の使用も検討します。目標とする血圧達成を目指しながら、血清尿酸値が高くなれば尿酸降下薬を併用しています。
尿酸降下薬は血清尿酸値8.0mg/dL以上で開始を検討しますが、高血圧を合併した高尿酸血症では排泄低下型が多いことから、まずは尿酸排泄促進薬を検討しています。ただし、後に登場した非プリン骨格の尿酸生成抑制薬は病型を問わずに有効であることから、最近は使用が増えています。
久留先生
厳格な降圧が必要なケースについてはどのようなことに気を付けておられますか。
大坪先生
なるべく錠数が増えないように、少しでも血清尿酸値によい影響のある薬剤と組み合わせて使用するという観点からロサルタンカリウムを使用することが多いです。また、ミネラルコルチコイド受容体(MR)拮抗薬は血清尿酸値に影響を及ぼさないと考えられていますので、腎機能やカリウム値、レニン活性、アルドステロン濃度を測定したうえで、特に低レニンの方には積極的に検討します。
久留先生
生活習慣の改善については具体的にどのような指導をされていますか。
大坪先生
まず塩分制限を強く指導しています。飲酒については男性25g、女性20gまでに抑え、休肝日を設けていただくようお伝えしています。また、指導ではありませんが、プリン体を多く含むDNAやRNAの入ったサプリメントを摂られていることがありますので、サプリメントの摂取状況についての聞き取りにも注意しています。
久留先生
血清尿酸値と高血圧の関係は、女性や若年者で関連性が強いというお話でした。女性の高血圧合併高尿酸血症の治療で注意されていることはありますか。
大坪先生
女性で高血圧があり血清尿酸値が高い方は、腎機能が低下している場合を除けば、肥満があったりアルコール摂取量が多かったりする方が中心です。肥満の是正や飲酒量低減といった生活習慣の指導をより強化し、「女性は心血管疾患などのリスクが高いので、7.0mg/dLを超えなければいいのではなく、尿酸値を6.0mg/dL以下にコントロールしておいたほうがいいですよ」と患者に数値目標を提示するようにしています。
表1: 高尿酸血症合併高血圧に対する高血圧治療

文献4) より改変・引用
久留先生
ありがとうございました。高血圧を合併する高尿酸血症患者に対する治療戦略の基本は血圧治療を優先することであり、その際の治療薬の選択や生活習慣の指導についても解説していただきました。今後、高血圧合併高尿酸血症患者を対象に、尿酸降下薬により血清尿酸値を低下させることで心血管疾患の発症・進展を抑制するかを検討した大規模介入試験が実施されることを期待します。
大坪先生
本日はありがとうございました。
References
1) 藤森 新,他. 痛風と核酸代謝. 2006; 30: 13.
2) Choi HK, et al. Rheumatology (Oxford). 2008; 47: 713-7.
3) 日本痛風・尿酸核酸学会ガイドライン改訂委員会(編).高尿酸血症・
痛風の治療ガイドライン第3版.東京:診断と治療社;2018.
4) Choi HK, et al. BMJ. 2012; 344: d8190.
5) Waldman B, et al. Lancet Diabetes Endocrinol. 2018; 6: 310-8.
6) Fralick M, et al. Ann Intern Med. 2020; 172: 186-94.
7) Kuwabara M, et al. Hypertension. 2017; 69: 1036-44.
8) 藤井弘二, 他. 日本臨牀. 2002; 60: 1949-56.
9) 萩原俊男(監).脂質異常症・肥満―動脈硬化―.大阪:メディカルレビュー社;2012.
10) Johnson RJ, et al. Hypertension. 2003; 41: 1183-90.
11) Baldwin W, et al. Diabetes. 2011; 60: 1258-69.
12) Mishima M, et al. Drug Res. 2016; 66: 270-4.
13) Radi R, et al. Arch Biochem Biophys. 1997; 339: 125-35.
14) White CR, et al. Proc Natl Acad Sci USA. 1996; 93: 8745-9.
15) Ives A, et al, Nat Commun. 2015; 6: 6555.
16) Mercuro G, et al. Am J Cardiol. 2004; 94: 932-5.
17) Kato M, et al. Am J Cardiol. 2005; 96: 1576-8.
18) Tomiyama H, et al. Am J Hypertens. 2011; 24: 770-4.
19) Kanbay M, et al. Am J Nephrol. 2014; 39: 348-56.
20) Higgins P, et al. Cardiovasc Ther. 2012; 30: 217-26.
21) Kanbay M, et al. Clin J Am Soc Nephrol. 2011; 6: 1887-94.
22) Alper AB Jr, et al.Hypertension. 2005; 45: 34-8.
23) Perlstein TS, et al.Hypertension. 2006; 48: 1031-6.
24) Grayson PC, et al. Arthritis Care Res (Hoboken). 2011; 63: 102-10.
25) Kansui Y, et al. J Hypertens. 2018; 36: 1499-505.
26) Kuwabara M. Pulse (Basel). 2016; 3: 242-52.
27) Mazza A, et al. Biomed Pharmacother. 2017; 86: 590-4.
28) Lee JJ, et al. Clin Hypertens. 2015; 21: 14.
29) Feig Dl, et al. Hypertension. 2003; 42: 247-52.
30) Loeffler LF et al. Hypertension. 2012; 59: 811-7.
31) Park B et al. Am J Hypertens. 2017; 30: 713-8.
32) Mazzali M, et al. Hypertension.2001;38: 1101-6.
33) Mazzali M, et al. Am J Physiol Renal Physiol. 2002; 282: F991-7.
34) Soletsky B, et al. Hypertension. 2012; 60: 1148-56.
35) 榊美奈子, 他. 痛風と核酸代謝. 2013; 37:103-9.




久留先生
本日は、高血圧の専門家であり高尿酸血症・痛風にも精通しておられる大坪先生と、高血圧を合併する高尿酸血症患者に対する治療戦略について議論したいと思います。