こちらの情報が掲載されている
情報誌PDFはこちら
高尿酸血症をマネジメントする
尿酸 NEXT Stage 2024 No.1


高血圧には高尿酸血症が高頻度に合併することが知られており、わが国で高血圧専門外来に通院する高血圧患者に高尿酸血症(血清尿酸値7.0mg/dL超または尿酸降下薬服用者)が合併する割合は、男性で40.6%、女性では8.6%であったことが報告されている1)。また、高血圧に高尿酸血症が合併しやすい病態の1つとして、最近は内臓脂肪が蓄積するメタボリックシンドロームによるインスリン抵抗性が原因となる代謝障害が注目されている。具体的には、メタボリックシンドロームによるインスリン抵抗性が血圧を上昇させ、高尿酸血症をもたらすことになる2)。その機序としては、後述する高インスリン血症による交感神経の活性化に伴うレニン・アンジオテンシン系(RAS)の活性化とともに、高インスリン血症により腎近位尿細管のNa+依存性モノカルボン酸トランスポーターでのNa+と有機アニオンの再吸収が亢進し、血圧が上昇する3)。さらに、この有機アニオンと尿酸トランスポーターにより尿酸の再吸収が高まると同時に、インスリン抵抗性によるグリセルアルデヒド-3-リン酸系酵素活性低下の代償としてのペントースリン酸経路の活性化により尿酸の合成が亢進し、高尿酸血症が引き起こされるとわれわれは考えている3)。
一方で、高尿酸血症は新規高血圧発症の独立した危険因子でもあることが、メタ解析の結果として報告されている4)。では、尿酸降下薬による高尿酸血症への介入は、血圧の低下に繋がるのだろうか。この点については、アロプリノールによる尿酸降下療法により降圧が得られることがメタ解析の結果として示されている5)。
そこで、わが国の『高血圧治療ガイドライン 2019』6)では、血清尿酸値が7.0mg/dLを超える高血圧患者は高尿酸血症と診断し、まずは摂取エネルギーの適正化による肥満の是正、プリン体・果糖の摂取制限、飲酒制限、習慣的な有酸素運動などの生活指導を開始するとしている。また、血清尿酸値が8.0mg/dL以上であれば尿酸降下薬の開始を考慮し、血清尿酸値6.0mg/dL以下を管理目標とすることを推奨している。
高尿酸血症が高血圧のリスクとなることは国内外で注目され、その機序として一酸化窒素(NO)の産生低下、炎症によるNF-κBの活性化、酸化ストレスの増加とともに、血圧調整に重要な役割を担うRASの活性化が挙げられてきた7)。このことは、高尿酸血症を合併する高血圧患者を診る際には、RASが亢進している可能性を考慮しておく必要があることを意味している。
実際に、生活習慣病で外来受診した810名を連続して登録したわれわれの検討によると8)、血清尿酸値と血漿レニン活性には有意な相関(r=0.084、p=0.019)がみられていた(図1)3)。それまで、われわれはヒトのレニン遺伝子の転写調節機序についての検討を行い、生理学的レベルでの調節機序は、細胞圧受容体、遠位尿細管Na+量、交感神経刺激の3系統であり9)、細胞内シグナルレベルでは、主としてcAMP、Caが重要であることを報告してきた10)。しかし、血漿レニン活性値の決定因子として遺伝因子(遠位エンハンサー)11)と各種環境因子との重回帰分析では、尿酸値は独立した決定因子とはならなかった8)。この理由としては、メタボリックシンドロームの病態ではRASが亢進しており、これが強い交絡因子として影響したものと考える。
一方で、高尿酸血症モデルラットでレニン陽性細胞が増加すること12)、ヒト血管内皮細胞で高尿酸状態による酸化ストレスがARBやACE阻害薬により減弱すること13)、ヒトによる検討から高尿酸血症状態ではアンジオテンシンⅡに対する腎血漿流量の反応が低下すること14)、高尿酸状態では脂肪細胞におけるRAS因子の発現が増加すること15)などの成績が示されている。
以上を踏まえると、高血圧の危険因子である高尿酸血症はRASを活性化させ、インスリン抵抗性が亢進するメタボリックシンドロームの病態全体に影響を及ぼしていることが示唆される(図2)3)。
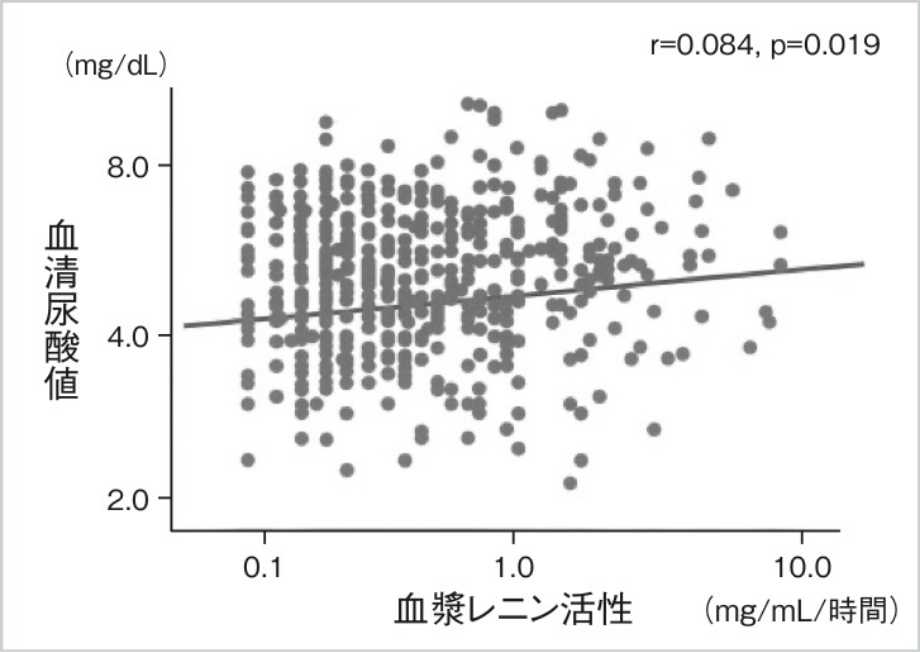
図1血漿レニン活性と血清尿酸値(両対数変換)
文献3より引用
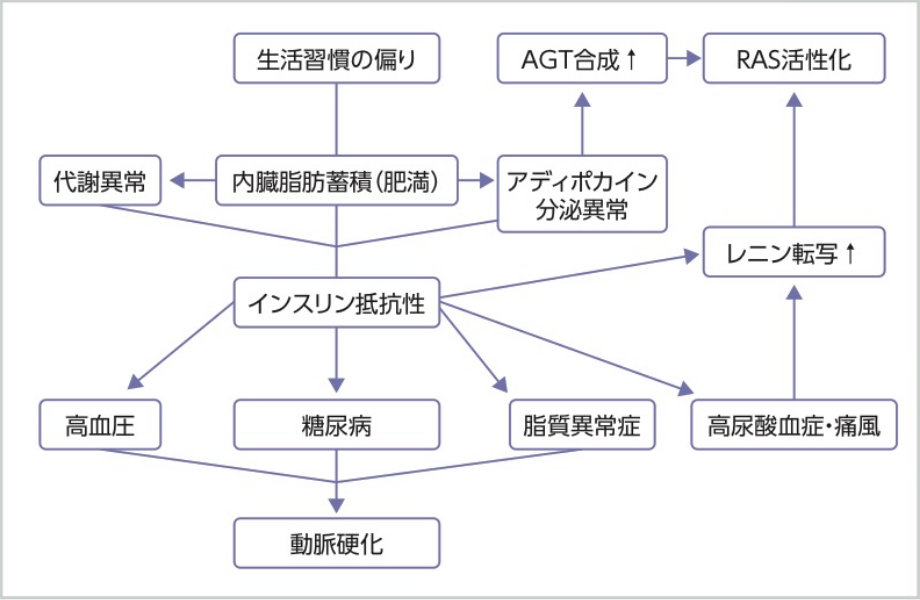
図2メタボリックシンドロームと尿酸、RAS
AGT:アンジオテンシノーゲン
文献3より引用
このように、高血圧と高尿酸血症はともにRASが活性化していることから、高尿酸血症を合併する高血圧患者に対してはRASを阻害する降圧薬が選択肢となり、ARBやACE阻害薬が第一選択薬となる。なお、ARBのなかでもロサルタンはURAT1阻害作用を有し16)、臨床的にも尿酸値を低下させることが報告されている17)。また、Ca拮抗薬も尿酸代謝に影響を及ぼさない(一部の薬剤は尿酸降下作用を有する6))。以上を考慮すると高尿酸血症を合併する高血圧患者に対しては、ARB、ACE阻害薬、Ca拮抗薬の選択が望ましく、単剤で血圧コントロールが困難な場合にはARBまたはACE阻害薬とCa拮抗薬の配合剤という選択肢もある。
また、メタボリックシンドローム、高齢者、慢性腎臓病(CKD)合併患者などは食塩感受性が高い病態が多く、利尿薬が有効なこともある。利尿薬については、慢性心不全合併患者に対し、貯留した水分やナトリウムの排泄によって、うっ血を改善、心不全症状の軽減目的で使用する。しかしながら、尿酸値を上昇させることが知られており、定期的に血清尿酸値を確認し、必要に応じて尿酸降下薬を併用するなど、尿酸管理をしっかりと行うことも重要となる。
References
1) 榊美奈子, 他. 痛風と核酸代謝. 2013;37:103-9.
2) 市田公美. 日薬理誌. 2010;136:321-4.
3) 此下忠志, 他, 高尿酸血症と痛風. 2017;25:111-6.
4) Grayson PC, et al. Arthritis Care Res (Hoboken). 2011;63:102-10.
5) Agarwal V, et al. J Clin Hypertens (Greenwich). 2013;15:435-42.
6) 日本高血圧学会高血圧治療ガイドライン作成委員会(編). 高血圧治療ガイドライン2019. 東京:ライフサイエンス出版;2019.
7) Mallat SG, et al. Curr Hypertens Rep. 2016;18:74.
8) Konoshita T, et al. Medicine (Baltimore). 2014;93:e354.
9) 此下忠志, 他. 痛風と尿酸・核酸. 2019;43:11-7.
10) Konoshita T. Curr Hypertens Rep. 2011;13:356-61.
11) Makino Y, et al. PLoS One. 2015;10:e0137469.
12) Mazzali M, et al. Hypertension. 2001;38:1101-6.
13) Yu MA, et al. J Hypertens. 2010;28:1234-42.
14) Perlstein TS, et al. Kidney Int. 2004;66:1465-70.
15) Zhang JX, et al. Endocrine. 2015;48:135-42.
16) Hamada T, et al. Am J Hypertens. 2008;21:1157‒62.
17) Ito S, et al. Hypertens Res. 2012;35:867-73.